공개특허 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) C07K 16/18 ( ) A61K 39/395 ( ) A61P 19/00 ( ) (21) 출원번
|
|
|
- 미진 간
- 4 years ago
- Views:
Transcription
1 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) C07K 16/18 ( ) A61K 39/395 ( ) A61P 19/00 ( ) (21) 출원번호 ( 분할 ) (22) 출원일자 ( 국제 ) 2006 년 04 월 28 일 심사청구일자 2013 년 11 월 01 일 (62) 원출원특허 원출원일자 ( 국제 ) 심사청구일자 2011 년 04 월 28 일 (85) 번역문제출일자 2013 년 11 월 01 일 (86) 국제출원번호 PCT/US2006/ (87) 국제공개번호 WO 2006/ 국제공개일자 (30) 우선권주장 2006 년 11 월 09 일 2006 년 04 월 28 일 11/411, 년 04 월 25 일미국 (US) ( 뒷면에계속 ) (11) 공개번호 (43) 공개일자 2013년11월20일 (71) 출원인 유씨비파마, 에스. 에이. 벨기에브뤼셀알리드라르쉐르쉐 60 ( 우 :1070) 암젠인크 미국캘리포니아 , 사우전드오크, 원암젠센터드라이브 (72) 발명자 파스즈티, 크리스토퍼 미국 캘리포니아주벤츄라웨스트리지드라이브 1027 로빈슨, 마틴, 킴 영국에이치피 10 0 제이에이치우번그린버킹엄셔어하베이힐너서리코티지 ( 뒷면에계속 ) (74) 대리인 김영, 양영준 전체청구항수 : 총 64 항 (54) 발명의명칭스클레로스틴결합제 (57) 요약 본발명은스클레로스틴단백질의에피토프및스클레로스틴결합제, 예를들면스클레로스틴과결합할수있는항체와관련된조성물및방법을제공한다. 대표도 - 1 -
2 (72) 발명자 그라함, 케빈 미국 캘리포니아주싸우전드오크스차터우드코트 1627 헨리, 알리스테어, 제임스 영국유비 8 2 엘엑스억스브리지미들섹스카울리로드 92 호프만, 켈리, 수 미국 캘리포니아주뉴베리파크그린밸리드라이브 795 라쌈, 존 미국 워싱턴주시애틀 10 번애비뉴웨스트 2409 로슨, 알래스테어 영국에스엘 1 3 더블유이슬라우버크셔배쓰로드 208 루, 시엥, 센 미국 캘리포니아주웨스트레이크빌리지레인필드애비뉴 2758 포플웰, 앤디 영국에스엘 1 3 더블유이슬라우버크셔배쓰로드 208 셴, 웬얀 미국 캘리포니아주싸우전드오크스어텀리지드라이브 2757 윙클러, 데이비드 미국 매사추세츠주알링턴조지스트리트 127 윈터스, 아론, 조지 미국 캘리포니아주벤츄라피어폰트불러바드 2501 (30) 우선권주장 60/677, 년05월03일미국 (US) 60/776, 년02월24일미국 (US) 60/782, 년03월13일미국 (US) 60/792, 년04월17일미국 (US) - 2 -
3 특허청구의범위청구항 1 서열 2, 서열 3, 서열 4 및서열 5의아미노산서열중 1종이상, 2종이상, 3종이상, 또는 4종모두로본질적으로이루어지고, 동물에게투여시에서열 1의스클레로스틴에특이적인항체를유발하는폴리펩티드. 청구항 2 제1항에있어서, 서열 5로이루어진폴리펩티드. 청구항 3 제1항에있어서, 서열 2, 서열 3, 서열 4 및서열 5의아미노산서열을갖는폴리펩티드이며, 여기서서열 2 및서열 4는서열 1을참조하면아미노산위치 57 및 111에서의디술피드결합에의해연결되어있고, 서열 3 및서열 5는 (a) 서열 1을참조하면아미노산위치 82 및 142에서의디술피드결합, 및 (b) 서열 1을참조하면아미노산위치 86 및 144에서의디술피드결합중 1개이상에의해연결되어있으며, 상기폴리펩티드가서열 1의인간스클레로스틴의트립신소화에의해수득되고인간스클레로스틴의상응하는폴리펩티드영역의 3차구조를보유하는것인폴리펩티드. 청구항 4 서열 70, 서열 71, 서열 72 및서열 73의아미노산서열을갖는폴리펩티드이며, 여기서서열 72 및서열 73은서열 1을참조하면아미노산위치 57 및 111에서의디술피드결합에의해연결되어있고, 서열 70 및서열 71은 (a) 서열 1을참조하면아미노산위치 82 및 142에서의디술피드결합, 및 (b) 서열 1을참조하면아미노산위치 86 및 144에서의디술피드결합중 1개이상에의해연결되어있는것인, 폴리펩티드. 청구항 5 (a) 인간스클레로스틴을완전한트립신소화가달성되도록트립신처리하는단계, (b) 평균분자량이 7,122.0 달톤 ( 이론적질량 7,121.5 달톤 ) 이거나, 또는전자분무이온화액체결정질량분광법에의해또는 0.05% 트리플루오로아세트산중 0.05% 트리플루오로아세트산에서 90% 아세토니트릴로의선형구배를 0.2 ml/ 분의유속으로이용한역상 HPLC 컬럼으로부터의용출로측정시에체류시간이약 20.6분인트립신소화샘플을수집하는단계, 및 (c) 상기트립신소화샘플로부터서열 1의인간스클레로스틴의단편을정제하는단계에의해생성된, 서열 1의인간스클레로스틴의단편인폴리펩티드. 청구항 6 제1항내지제5항중어느한항에따른폴리펩티드를포유동물에투여하는단계를포함하는, 항체또는그의단편의생성방법. 청구항 7 제1항내지제5항중어느한항에따른폴리펩티드에 1 x 10-7 M 이하의결합친화도 (Kd) 로결합하는항체또는그의항원결합단편. 청구항 8 제7항에있어서, 서열 6의에피토프에도결합하는항체또는그의항원결합단편. 청구항 9 제7항에있어서, 항체 Ab-C, Ab-D, Ab-2, Ab-3, Ab-11, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-21 또는 Ab-22와서열 1의스클레로스틴의결합을교차-차단 (cross-block) 하고 / 하거나항체 Ab-C, Ab-D, Ab-2, Ab
4 3, Ab-11, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-21 또는 Ab-22에의해서열 1의스클레로스틴과의결합이교차-차단되는항체또는그의항원결합단편. 청구항 10 제7항의항체또는그의항원결합단편과서열 1의인간스클레로스틴의결합을교차-차단하고 / 하거나제7항의항체또는그의항원결합단편에의해서열 1의인간스클레로스틴과의결합이교차-차단되는항체또는그의항원결합단편. 청구항 11 제10항에있어서, 상기항체또는그의항원결합단편이교차-차단하거나또는교차-차단되는능력이비아코어 (Biacore) 검정또는 ELISA 검정으로검출되는것인항체또는그의항원결합단편. 청구항 12 서열 1의아미노산서열을포함하는스클레로스틴폴리펩티드에결합하고, 서열 1 내의서열 2, 서열 3, 서열 4 및서열 5 중하나이상의서열에결합하는항체또는그의항원결합단편. 청구항 13 항체 Ab-C, Ab-D, Ab-2, Ab-3, Ab-11, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-21 또는 Ab-22과스클레로스틴의결합을교차-차단하고 / 하거나 1종이상의제2 항체에의해스클레로스틴과의결합이교차-차단되는항체또는그의항원결합단편. 청구항 14 a) 서열 48, 49 및 50의 CDR 서열및서열 45, 46 및 47의 CDR 서열 ; b) 서열 42, 43 및 44의 CDR 서열및서열 39, 40 및 41의 CDR 서열 ; c) 서열 278, 279 및 280의 CDR 서열및서열 290, 291 및 292의 CDR 서열 ; d) 서열 284, 285 및 286의 CDR 서열및서열 296, 297 및 298의 CDR 서열 ; e) 서열 275, 276 및 277의 CDR 서열및서열 287, 288 및 289의 CDR 서열 ; f) 서열 281, 282 및 283의 CDR 서열및서열 293, 294 및 295의 CDR 서열 ; g) 서열 116, 237 및 238의 CDR 서열및서열 266, 267 및 268의 CDR 서열 ; 또는 h) 서열 242, 243 및 244의 CDR 서열및서열 272, 273 및 274의 CDR 서열을포함하는항체또는그의항원결합단편. 청구항 15 제14항에있어서, (a) 서열 129에제공된서열을갖는폴리펩티드를포함하는중쇄및서열 125에제공된서열을갖는폴리펩티드를포함하는경쇄 ; (b) 서열 225 또는 394에제공된서열을갖는폴리펩티드를포함하는중쇄및서열 221에제공된서열을갖는폴리펩티드를포함하는경쇄 ; (c) 서열 209에제공된서열을갖는폴리펩티드를포함하는중쇄및서열 205에제공된서열을갖는폴리펩티드를포함하는경쇄 ; (d) 서열 217 또는 393에제공된서열을갖는폴리펩티드를포함하는중쇄및서열 213에제공된서열을갖는폴리펩티드를포함하는경쇄 ; (e) 서열 19에제공된서열을갖는폴리펩티드를포함하는중쇄및서열 15에제공된서열을갖는폴리펩티드를포함하는경쇄 ; 또는 (f) 서열 11에제공된서열을갖는폴리펩티드를포함하는중쇄및서열 7에제공된서열을갖는폴리펩티드를 - 4 -
5 포함하는경쇄를포함하는항체또는그의항원결합단편. 청구항 16 (i) 서열 205의아미노산서열을포함하는경쇄및서열 209의아미노산서열을포함하는중쇄를포함하는제2 항체와서열 1의스클레로스틴의결합을교차-차단하거나, (ii) 상기제2 항체에의해서열 1의스클레로스틴과의결합이교차-차단되는항체또는그의항원결합단편. 청구항 17 (a) (i) 서열 15의아미노산서열을포함하는경쇄및서열 19의아미노산서열을포함하는중쇄, 또는 (ii) 서열 7의아미노산서열을포함하는경쇄및서열 11의아미노산서열을포함하는중쇄를포함하는제2 항체와서열 1의스클레로스틴의결합을교차-차단하거나, (b) 상기제2 항체에의해서열 1의스클레로스틴과의결합이교차-차단되는항체또는그의항원결합단편. 청구항 18 제12항내지제17항중어느한항에있어서, 포유동물에서골형성, 골무기질밀도, 골무기질함량, 골질량, 골질및골강도중하나이상을증가시킬수있고 / 있거나세포기재의무기질침착검정에서스클레로스틴의억제효과를차단할수있는항체또는그의항원결합단편. 청구항 19 제13항, 제16항및제17항중어느한항에있어서, 표면플라스몬공명검정에서, 검정동안제2 항체의존재하에기록된결합수준이최대이론적결합수준의 80% 내지 4% 가되도록스클레로스틴에결합하는항체또는그의항원결합단편. 청구항 20 제19항에있어서, 표면플라스몬공명검정에서, 검정동안제2 항체의존재하에기록된결합수준이최대이론적결합수준의 70% 내지 4% 가되도록스클레로스틴에결합하는항체또는그의항원결합단편. 청구항 21 제13항, 제16항및제17항중어느한항에있어서, 용액중항체또는그의항원결합단편또는제2 항체의부재하에결합된스클레로스틴양과비교하여, (a) ELISA 검정시용액중항체또는그의항원결합단편이고정화된제2 항체가결합된스클레로스틴의양을 60% 내지 100% 감소시키고 / 시키거나 (b) ELISA 검정시용액중제2 항체가고정화된항체또는그의항원결합단편이결합된스클레로스틴의양을 60% 내지 100% 감소시키는것인, 항체또는그의항원결합단편. 청구항 22 제21항에있어서, 고정화된항체또는그의항원결합단편또는제2 항체가결합된스클레로스틴의양을 80% 내지 100% 감소시키는항체또는그의항원결합단편. 청구항 23 제12항내지제17항중어느한항에있어서, 항체인항체또는그의항원결합단편. 청구항 24 제23항에있어서, 중쇄및경쇄를포함하는이뮤노글로불린인항체또는그의항원결합단편. 청구항
6 제23항에있어서, IgG 항체인항체또는그의항원결합단편. 청구항 26 제23항에있어서, 모노클로날항체인항체또는그의항원결합단편. 청구항 27 제23항에있어서, 키메라항체, 인간화항체또는인간항체인항체또는그의항원결합단편. 청구항 28 제12항내지제17항중어느한항에있어서, 항체단편을포함하는항체또는그의항원결합단편. 청구항 29 제28항에있어서, 경쇄가변영역, 중쇄가변영역, F(ab') 2, Fab, Fab', Fv, Fc 또는 Fd 단편을포함하는항체또는그의항원결합단편. 청구항 30 제12항내지제17항중어느한항에있어서, 단리된항체또는그의항원결합단편. 청구항 31 제12항내지제17항중어느한항에있어서, 재조합항체또는그의항원결합단편. 청구항 32 제12항내지제17항중어느한항에있어서, 인간스클레로스틴에 1 x 10-7 M 이하, 1 x 10-8 M 이하, 1 x 10-9 M 이하, 1 x M 이하, 1 x M 이하또는 1 x M 이하의결합친화도 (K d ) 로결합하는항체또는그의항원결합단편. 청구항 33 인간스클레로스틴에 1 x 10-9 M 이하, 1 x M 이하, 1 x M 이하또는 1 x M 이하의결합친화도 (K d ) 로결합하는항체또는그의항원결합단편. 청구항 34 제12항내지제17항및제33항중어느한항에있어서, 하나이상의이펙터 (effector) 또는리포터분자 ( 들 ) 이부착된항체또는그의항원결합단편. 청구항 35 제12항내지제17항및제33항중어느한항에따른항체또는그의항원결합단편을코딩하는단리된폴리뉴클레오티드. 청구항 36 제35항의폴리뉴클레오티드를하나이상포함하는클로닝또는발현벡터. 청구항 37 제36항에있어서, 서열 126, 128, 130, 132, 222, 224, 226, 228, 385, 387, 206, 208, 210, 212, 214, 216, 218, 220, 381 및 383으로이루어진군으로부터선택된하나이상의서열을포함하는클로닝또는발현벡터. 청구항 38 제36항에따른클로닝또는발현벡터를하나이상포함하는숙주세포
7 청구항 39 제38항의숙주세포를배양하는단계및항체또는그의항원결합단편을단리하는단계를포함하는, 항체또는그의항원결합단편의제조방법. 청구항 40 제12항내지제17항및제33항중어느한항의항체또는그의항원결합단편을 1종이상의제약상허용되는부형제, 희석제또는담체와조합하여포함하는제약조성물. 청구항 41 제40항에있어서, 스클레로스틴에의해매개되거나또는스클레로스틴의수준증가와관련되는병리학적장애의치료또는예방을위한제약조성물. 청구항 42 제40항에있어서, 포유동물에서골형성, 골무기질함량, 골질량, 골무기질밀도, 골질및골강도중하나이상을증가시키거나또는포유동물에서골-관련장애를치료하기위한제약조성물. 청구항 43 제42항에있어서, 골-관련장애가연골무형성증, 쇄골두개골이골증, 연골종증, 섬유상이형성증, 고쉐 (Gaucher) 병, 저포스페이트혈성구루병, 마르판 (Marfan) 증후군, 다발성유전성외골증, 신경섬유종증, 불완전골생성증, 골화석증, 골반문증, 경화성병변, 가관절증, 화농성골수염, 치주질환, 항간질성약물-유발골손실, 원발성및속발성부갑상선기능항진, 가족성부갑상선기능항진증후군, 체중감소-유발골손실, 남성골다공증, 폐경후골손실, 골관절염, 신성골이영양증, 침윤성골장애, 구강골손실, 턱의골괴사, 연소성 (juvenile) 파제트 (Paget) 병, 유선상과골증, 대사성골질환, 비만세포증, 겸상적혈구빈혈 / 질환, 장기이식- 관련골손실, 신장이식-관련골손실, 전신성홍반성루푸스, 강직성척추염, 간질, 연소성관절염, 지중해빈혈, 점액다당류증, 파브리 (Fabry) 병, 터너 (Turner) 증후군, 다운 (Down) 증후군, 클라인펠터 (Klinefelter) 증후군, 나병, 페르테스 (Perthes) 질환, 청년기특발성척주측만증, 영아발병성다기관염증성질환, 윈체스터 (Winchester) 증후군, 멘케스 (Menkes) 병, 윌슨 (Wilson) 병, 허혈성골질환 ( 예, 레그-칼베-페르테스 (Legg- Calve-Perthes) 질환, 국부이동성골다공증 ), 빈혈상태, 스테로이드에의해유발된질병, 글루코코르티코이드 -유발골손실, 헤파린-유발골손실, 골수장애, 괴혈병, 영양실조, 칼슘결핍, 골다공증, 골감소증, 알콜중독, 만성간질환, 폐경후상태, 만성염증성질병, 류마티스성관절염, 염증성장질환, 궤양성대장염, 염증성대장염, 크론 (Crohn) 병, 희발월경, 무월경, 임신, 당뇨병, 갑상선기능항진, 갑상선장애, 부갑상선장애, 쿠싱 (Cushing) 병, 말단비대증, 성선기능저하증, 부동화또는무위 (disuse), 반사교감신경이상증후군, 국부골다공증, 골연화증, 관절대체와관련된골손실, HIV-관련골손실, 성장호르몬의손실과관련된골손실, 낭성섬유증과관련된골손실, 화학요법-관련골손실, 종양-유발골손실, 암-관련골손실, 호르몬절제골손실, 다발성골수종, 약물-유발골손실, 신경성거식증, 질환-관련안면골손실, 질환-관련머리뼈 (cranial bone) 손실, 질환-관련악골손실, 질환-관련두개골 (skull bone) 손실, 노화와관련된골손실, 노화와관련된안면골손실, 노화와관련된머리뼈손실, 노화와관련된악골손실, 노화와관련된두개골손실, 및우주여행과관련된골손실중하나이상인것인방법. 청구항 44 제43항에있어서, 골-관련장애가골다공증또는골감소증인제약조성물. 청구항 45 제40항에있어서, 정형외과시술, 치과시술, 이식수술, 관절대체, 골이식, 골미용수술및골복구중하나이상을거친포유동물에서의결과를개선하기위한제약조성물. 청구항 46 제45항에있어서, 골복구가골절치유, 불유합치유, 지연유합치유또는안면재건술인제약조성물
8 청구항 47 제12항내지제17항및제33항중어느한항의항체또는그의항원결합단편을포함하는진단키트. 청구항 48 서열 40, 41, 46, 47, 238, 242, 273, 274, 275, 278, 281, 283, 286, 288, 289, 291, 292, 294, 295, 297 및 298 중하나이상을포함하는폴리펩티드. 청구항 49 제48항에있어서, Fc, PEG, 알부민및트랜스페린중하나이상에접합된폴리펩티드. 청구항 50 제7항에있어서, IgG 항체인항체또는그의항원결합단편. 청구항 51 제50항에있어서, 모노클로날항체인항체또는그의항원결합단편. 청구항 52 제50항에있어서, 키메라항체, 인간화항체또는인간항체인항체또는그의항원결합단편. 청구항 53 제7항에있어서, 항체단편을포함하는항체또는그의항원결합단편. 청구항 54 제53항에있어서, 경쇄가변영역, 중쇄가변영역, F(ab') 2, Fab, Fab', Fv, Fc 또는 Fd 단편을포함하는항체또는그의항원결합단편. 청구항 55 제7항에있어서, 단리된항체또는그의항원결합단편. 청구항 56 제7항에있어서, 재조합항체또는그의항원결합단편. 청구항 57 제7항의항체또는그의항원결합단편을 1종이상의제약상허용되는부형제, 희석제또는담체와조합하여포함하는제약조성물. 청구항 58 제57항에있어서, 스클레로스틴에의해매개되거나또는스클레로스틴의수준증가와관련되는병리학적장애의치료또는예방을위한제약조성물. 청구항 59 제57항에있어서, 포유동물에서골형성, 골무기질함량, 골질량, 골무기질밀도, 골질및골강도중하나이상을증가시키거나또는포유동물에서골-관련장애를치료하기위한제약조성물. 청구항 60 제59항에있어서, 골-관련장애가골다공증또는골감소증인제약조성물. 청구항
9 제57항에있어서, 정형외과시술, 치과시술, 이식수술, 관절대체, 골이식, 골미용수술및골복구중하나이상을거친포유동물에서의결과를개선하기위한제약조성물. 청구항 62 제61항에있어서, 골복구가골절치유, 불유합치유, 지연유합치유또는안면재건술인제약조성물. 청구항 63 제59항에있어서, 포유동물이폐경후여성인제약조성물. 청구항 64 제42항에있어서, 포유동물이폐경후여성인제약조성물. 명세서 [0001] 기술분야 본발명은일반적으로인간스클레로스틴 (sclerostin) 단백질을비롯한스클레로스틴단백질의에피토프, 및스 클레로스틴또는그의단편에결합할수있는결합제 ( 예를들어항체 ) 에관한것이다. [0002] [0003] 배경기술개인의일생에걸쳐골질량에있어서의 2회또는 3회의별개의변화기가발생한다 ( 문헌 [Riggs, West J, Med. 154:63-77 (1991)] 참조 ). 제1기는남성과여성둘다에서발생하며, 최고의골질량달성으로진행된다. 이러한제1기는연골내성장판의선형성장및골막부착속도에따른방사형 (radial) 성장을통해달성된다. 제2 기는골소주 ( 小注 ) ( 척추및골반등과같은평평한뼈 ) 의경우에는약 30세정도, 피질골 ( 예를들어, 사지에존재하는긴뼈 ) 의경우에는약 40세정도에시작되어노령까지지속된다. 이시기는느린골소실을특징으로하며, 남성과여성둘다에서발생한다. 여성의경우, 골소실의제3기가또한발생하며, 대개는폐경후에스트로겐결핍으로인한다고여겨진다. 이시기만보면, 이동안에여성은피질골및소주구획 ( 문헌 [Riggs, 상기문헌 ] 참조 ) 으로부터추가의골질량을소실할수있다. 골무기질함량의소실은매우다양한조건에의해야기될수있으며, 유의한의학적문제가초래될수있다. 예를들어, 골다공증은인간에서의허약화질환이며, 골격골질량및무기질밀도에있어서의현저한감소, 골미세구조의붕괴및상응하는골취약성증가 ( 즉, 골강도의감소 ) 등을비롯한뼈의구조적퇴행, 및골다공증에걸린개인에서골절에대한감수성을특징으로한다. 일반적으로, 인간에서의골다공증은미국에서대략 2천 5백만명의사람들에서발견되는상태인임상적골감소증 ( 골무기질밀도가젊은성인뼈의평균값보다표준편차 1 초과내지 2.5 미만으로부족함 ) 이먼저일어난다. 미국에서는또다른 7백만내지 8백만명의환자가임상적골다공증 ( 골무기질함량이장년성인뼈보다 2.5 표준편차초과가부족한것으로정의됨 ) 으로진단되었다. 인간집단에서의골다공증빈도는연령에따라증가한다. 백인중에서는골다공증이여성에서우세하며, 미국에서는골다공증환자전체중 80% 가여성이다. 나이든사람에서골격골의골절에대한취약성및감수성증가는이집단에서넘어질위험이더크다는것으로악화된다. 둔부, 손목및척추의골절이골다공증과관련된가장흔한상해이다. 특히둔부골절은환자에게매우불편하고비용이많이들며, 여성의경우에는높은비율의사망률및이환률과상관관계가있다. 발명의내용 [0004] 해결하려는과제골다공증은골질량감소로인한골절위험의증가로간주되어왔지만, 현재이용할수있는골격장애의치료법중성인의골밀도를증가시킬수있는것은거의없고, 현재이용할수있는치료법대개가새로운골형성을자극하는것이아니라주로추가의골흡수를억제하는작용을한다. 골소실을지연시키는데는현재에스트로겐이처방되고있다. 그러나, 환자에게임의의장기간이익이있는지여부및에스트로겐이 75세가넘는환자에게임의의효과가있는지여부에대하여는약간의논란이있다. 추가로, 에스트로겐의사용은유방암및자궁내막암의위험을증가시킨다고여겨진다. 칼시토닌, 오스테오칼신및비타민 K, 또는비타민 D가함유되거나함유되지않은고용량의식이칼슘도폐경후여성을위해제안된바있다. 그러나, 고용량의칼슘은종종 - 9 -
10 원치않는위장부작용을일으키고, 혈청및뇨의칼슘수준이지속적으로모니터링되어야한다 ( 예를들어, 문 헌 [Khosla and Riggs, Mayo Clin. Proc. 70:978982, 1995] 참조 ). [0005] [0006] 골다공증에대한다른현행치료접근법은비스포스포네이트 ( 예를들어, 포사맥스 (Fosamax), 액토넬 (Actonel), 본비바 (Bonviva), 조메타 (Zometa), 올파드로네이트, 네리드로네이트, 스켈리드, 보네포스등 ), 부갑상선호르몬, 칼시라이틱스 (calcilytics), 칼슘모방체 (calcimimetics) ( 예를들어, 시나칼세트 (cinacalcet)), 스타틴, 동화성스테로이드, 란탄및스트론튬염, 및불화나트륨을포함한다. 그러나, 이러한치료제는종종바람직하지않은부작용과관련이있다 ( 문헌 [Khosla and Riggs, 상기문헌 ] 참조 ). 골과다성장및매우치밀한골을특징으로하는골격질환인경화협착증 (sclerosteosis) 에는 SOST 유전자생성물인스클레로스틴이없다 ( 문헌 ([Brunkow et al., Am. J. Hum. Genet., 68: , 2001], [Balemans et al., Hum. Mol. Genet., 10: , 2001])). 인간스클레로스틴의아미노산서열은문헌 [Brunkow et al. 동일문헌 ] 에보고되어있고, 본원에서서열 1로개시되어있다. [0007] [0008] [0009] [0010] [0011] [0012] [0013] [0014] [0015] [0016] [0017] [0018] 과제의해결수단발명의간단한요약본원에서는, 골형성, 골무기질밀도, 골무기질함량, 골질량, 골질및골강도중 1종이상의증가에사용될수있어서, 골형성, 골무기질밀도, 골무기질함량, 골질량, 골질및골강도중 1종이상의증가가바람직한매우다양한상태의치료에이용될수있는조성물및방법을개시한다. 본발명은또한본원에기재된다른관련잇점도제공한다. 본발명은인간스클레로스틴에서본원에개시된결합제에의해인식되는영역 ( 에피토프 ), 이들에피토프의사용방법, 및이러한에피토프의제조방법에관한것이다. 본발명은또한스클레로스틴에서루프 (Loop) 2로동정된영역에특이적인에피토프, 및상기영역에특이적으로결합하는결합제에관한것이다. 본발명은또한스클레로스틴의시스틴-노트 (cystine-knot) 영역에특이적인에피토프, 및상기영역에특이적으로결합하는결합제, 예를들어항체에관한것이다. 본발명은스클레로스틴에특이적으로결합하는결합제, 예를들어항체에관한것이다. 상기결합제는본원에개시된 1종이상의항체가스클레로스틴에결합하는것을교차-차단하는 (cross-block) 능력, 및 / 또는본원에개시된 1종이상의항체에의해스클레로스틴과의결합으로부터교차-차단되는능력을특징으로할수있다. 또한, 상기항체및기타결합제는본원에개시된 " 인간스클레로스틴펩티드에피토프경쟁결합검정 " 에서인간스클레로스틴펩티드에대한결합패턴을특징으로할수도있다. 본발명은포유동물에서골형성, 골무기질밀도, 골무기질함량, 골질량, 골질및골강도중 1종이상을증가시킬수있는결합제, 예를들어항체에관한것이다. 본발명은세포기재의무기질침착검정에서스클레로스틴의억제효과를차단할수있는결합제, 예를들어항체에관한것이다. 본발명은추가로스클레로스틴의시스틴-노트영역의코어영역을대표하는, 1개이상의디술피드결합에의해연결된 2개, 3개또는 4개의폴리펩티드단편을포함하는폴리펩티드구조물, 및그에특이적으로결합할수있는항체에관한것이다. 본발명은포유동물에서스클레로스틴에특이적으로결합할수있는결합제, 예를들어항체를생성하는데면역원으로사용하기에적합한에피토프의수득방법에관한것이며, 특정실시양태에서는생성된상기결합제가스클레로스틴활성을생체내중화시킬수있다. 본발명은서열 6, 서열 63, 서열 64, 서열 65, 서열 66, 서열 67, 서열 68 또는서열 69의아미노산서열을갖는폴리펩티드를포함하는, 동물에게투여시에스클레로스틴에특이적인항체를유발하기위한조성물에관한것이다. 본발명은또한서열 2, 서열 3, 서열 4 또는서열 5의아미노산서열로본질적으로이루어진 1종이상의폴리펩티드를포함하는, 동물에게투여시에스클레로스틴에특이적인항체를유발하기위한조성물에관한것이며, 상기조성물은서열 2, 서열 3, 서열 4 및서열 5의아미노산서열중 2종이상또는 3종이상을포함할수있
11 고, 상기조성물은서열 2, 서열 3, 서열 4 및서열 5 의아미노산서열 4 종모두를포함할수있다. [0019] [0020] [0021] [0022] [0023] [0024] [0025] [0026] [0027] [0028] [0029] [0030] [0031] [0032] [0033] [0034] [0035] [0036] [0037] [0038] [0039] [0040] 본발명은추가로서열 2, 서열 3, 서열 4 및서열 5의아미노산서열을갖는폴리펩티드를포함하며, 여기서서열 2 및서열 4는서열 1로언급하면아미노산위치 57 및 111에서의디술피드결합에의해연결되어있고, 서열 3 및서열 5는 (a) 서열 1로언급하면아미노산위치 82 및 142에서의디술피드결합, 및 (b) 서열 1로언급하면아미노산위치 86 및 144에서의디술피드결합중 1개이상에의해연결되어있으며, 상기폴리펩티드가서열 1의인간스클레로스틴의상응하는폴리펩티드영역의 3차구조를보유할수있는, 동물에게투여시에스클레로스틴에특이적인항체를유발하기위한조성물에관한것이다. 본발명은또한서열 1의여러회말단절단 (truncation) 된인간스클레로스틴단백질로본질적으로이루어지고, 서열 1의아미노산 1 내지 50, 65 내지 72, 91 내지 100, 118 내지 137, 및 150 내지 190이없는폴리펩티드 T20.6에관한것이며, 상기폴리펩티드는인간스클레로스틴의트립신소화로수득될수있고, 상기단백질은 HPLC 분획화로단리될수있다. 본발명은추가로서열 1의아미노산 51 내지 64, 73 내지 90, 101 내지 117, 및 138 내지 149를포함하고, (a) 아미노산 57과 111 사이의디술피드결합, (b) 아미노산 82와 142 사이의디술피드결합, 및 (c) 아미노산 86과 144 사이의디술피드결합중 1개이상을포함하는인간스클레로스틴의면역원성부분 T20.6에관한것이며, 상기면역원성부분은이들디술피드결합중 2개이상을가질수있고, 상기면역원성부분은상기디술피드결합 3개모두를가질수있다. 본발명은추가로서열 1의아미노산 57 내지 64, 73 내지 86, 111 내지 117, 및 138 내지 144를포함하고, (a) 아미노산 57과 111 사이의디술피드결합, (b) 아미노산 82와 142 사이의디술피드결합, 및 (c) 아미노산 86과 144 사이의디술피드결합중 1개이상을포함하는인간스클레로스틴의면역원성부분 T20.6 유도체에관한것이며, 상기면역원성부분은이들디술피드결합중 2개이상을가질수있고, 상기면역원성부분은상기디술피드결합 3개모두를가질수있다. 본발명은추가로 C-말단부및 N-말단부에서말단절단된서열 1의인간스클레로스틴단백질로본질적으로이루어지고, 서열 1의아미노산 1 내지 85 및 112 내지 190이없는폴리펩티드에관한것이다. 본발명은또한서열 1의아미노산 86 내지 111을포함하는인간스클레로스틴의면역원성부분에관한것이며, 상기면역원성부분은연속아미노산 CGPARLLPNAIGRGKWWRPSGPDFRC ( 서열 6) 로본질적으로이루어질수있다. 본발명은추가로서열 98의아미노산 92 내지 109를포함하는래트스클레로스틴의면역원성부분에관한것이며, 상기면역원성부분은연속아미노산 PNAIGRVKWWRPNGPDFR ( 서열 96) 로본질적으로이루어질수있다. 본발명은추가로서열 98의아미노산 99 내지 120을포함하는래트스클레로스틴의면역원성부분에관한것이며, 상기면역원성부분은연속아미노산 KWWRPNGPDFRCIPDRYRAQRV ( 서열 97) 로본질적으로이루어질수있다. 본발명은 (a) 인간스클레로스틴을완전한트립신소화가달성되도록처리하는단계, (b) 평균분자량이 7,122.0 달톤 ( 이론적질량 달톤 ) 이거나, 또는 0.05% TFA 중 0.05% 트리플루오로아세트산에서 90% 아세토니트릴로의선형구배를 0.2 ml/ 분의유속으로이용한역상 HPLC 컬럼으로부터의용출로측정시에체류시간이약 20.6분인트립신소화샘플을수집하는단계, 및 (c) 면역원성부분을정제하는단계를포함하는, 인간스클레로스틴의면역원성부분의생성방법에관한것이다. 본발명은
12 [0041] [0042] [0043] [0044] [0045] [0046] [0047] [0048] [0049] [0050] [0051] [0052] [0053] [0054] [0055] [0056] [0057] [0058] [0059] [0060] [0061] [0062] (a) 동물을서열 6, 서열 63, 서열 64, 서열 65, 서열 66, 서열 67, 서열 68, 서열 69, 서열 96 또는서열 97 의폴리펩티드를포함하는조성물로면역화하는단계, (b) 상기동물로부터혈청을수집하는단계, 및 (c) 상기혈청으로부터스클레로스틴에특이적으로결합할수있는항체를단리하는단계를포함하는, 스클레로스틴에특이적으로결합할수있는항체의생성방법에관한것이다. 또한, 본발명은 (a) 동물을폴리펩티드 T20.6 또는 T20.6의유도체를포함하는조성물로면역화하는단계, (b) 상기동물로부터혈청을수집하는단계, 및 (c) 상기혈청으로부터스클레로스틴에특이적으로결합할수있는항체를단리하는단계를포함하는, 스클레로스틴에특이적으로결합할수있는항체의생성방법에관한것이다. 추가로, 본발명은 (a) 생물학적샘플을, 항-스클레로스틴항체와서열 6, 서열 63, 서열 64, 서열 65, 서열 66, 서열 67, 서열 68, 서열 69, 서열 96 또는서열 97로본질적으로이루어진폴리펩티드사이의복합체형성을허용하는조건하에서열 6, 서열 63, 서열 64, 서열 65, 서열 66, 서열 67, 서열 68, 서열 69, 서열 96 또는서열 97로본질적으로이루어진폴리펩티드와접촉시키는단계, 및 (b) 상기복합체의존재또는부재를검출하는단계를포함하며, 여기서상기복합체의존재가상기생물학적샘플이항-스클레로스틴항체를함유함을지시하는것인, 생물학적샘플중항-스클레로스틴항체의검출방법에관한것이다. 본발명은또한 (a) 생물학적샘플을, 항-스클레로스틴항체와폴리펩티드 T20.6 또는 T20.6의유도체사이의복합체형성을허용하는조건하에폴리펩티드 T20.6 또는 T20.6의유도체와접촉시키는단계, 및 (b) 상기복합체의존재또는부재를검출하는단계를포함하며, 여기서상기복합체의존재가상기생물학적샘플이항-스클레로스틴항체를함유함을지시하는것인, 생물학적샘플중항-스클레로스틴항체의검출방법에관한것이다. 본발명은추가로항체 Ab-A, Ab-B, Ab-C 또는 Ab-D 중 1종이상이스클레로스틴단백질에결합하는것을교차- 차단하는스클레로스틴결합제, 예를들어항체에관한것이다. 스클레로스틴결합제는또한항체 Ab-A, Ab-B, Ab-C 또는 Ab-D 중 1종이상이스클레로스틴에결합하는것을교차-차단할수도있다. 단리된항체또는그의항원-결합단편은폴리클로날항체, 모노클로날항체, 인간화항체, 인간항체, 키메라항체등일수있다. 본발명은추가로항체 Ab-A, Ab-B, Ab-C 또는 Ab-D 중 1종이상이스클레로스틴에결합하는것을교차-차단하는스클레로스틴결합제, 예를들어항체에관한것이다. 단리된항체또는그의항원-결합단편은폴리클로날항체, 모노클로날항체, 인간화항체, 인간항체, 키메라항체등일수있다. 본발명은추가로항체 1 내지 24 (Ab-1 내지 Ab-24) 중 1종이상이스클레로스틴단백질에결합하는것을교차 -차단하는스클레로스틴결합제, 예를들어항체에관한것이다. 스클레로스틴결합제는또한항체 1 내지 24 (Ab-1 내지 Ab-24) 중 1종이상이스클레로스틴에결합하는것을교차-차단할수도있다. 단리된항체또는그의항원-결합단편은폴리클로날항체, 모노클로날항체, 인간화항체, 인간항체또는키메라항체일수있다. 본발명은추가로항체 1 내지 24 (Ab-1 내지 Ab-24) 중 1종이상이스클레로스틴에결합하는것을교차-차단하는스클레로스틴결합제, 예를들어단리된항체에관한것이며, 단리된항체또는그의항원-결합단편은폴리클로날항체, 모노클로날항체, 인간화항체, 인간항체, 키메라항체일수있다. 본발명은추가로 " 인간스클레로스틴펩티드에피토프경쟁결합검정 " 에서인간스클레로스틴펩티드에대해나타내는결합패턴이항체 Ab-A, Ab-B, Ab-C 또는 Ab-D 중 1종이상에의해나타나는결합패턴과유사한결합제, 예를들어단리된항체에관한것이며, 단리된항체또는그의항원-결합단편은폴리클로날항체, 모노클로날항체, 인간화항체, 인간항체또는키메라항체일수있다
13 [0063] [0064] [0065] [0066] [0067] [0068] [0069] 본발명은추가로낮은골형성, 낮은골무기질밀도, 낮은골무기질함량, 낮은골질량, 낮은골질및낮은골강도중 1종이상과관련이있는골장애의치료가필요한포유동물대상체에게골형성, 골무기질밀도, 골무기질함량, 골질량, 골질및골강도중 1종이상을증가시키는데충분한양의항-스클레로스틴결합제를제공하는단계를포함하고, 상기항-스클레로스틴결합제는항체또는그의스클레로스틴-결합단편을포함하는것인, 포유동물대상체에서낮은골형성, 낮은골무기질밀도, 낮은골무기질함량, 낮은골질량, 낮은골질및낮은골강도중 1종이상과관련이있는골장애의치료방법에관한것이다. 본발명은또한단리된스클레로스틴폴리펩티드또는그의단편에관한것이고, 여기서상기폴리펩티드는 6개의보존된시스테인잔기를함유하고, 그의단편은서열 2의 7개내지 14개아미노산, 서열 3의 8개내지 17개아미노산, 서열 4의 8개내지 18개잔기, 및서열 5의 6개내지 12개잔기를포함하며, 상기폴리펩티드또는그의단편은서열 2와서열 4 사이의디술피드결합, 및서열 3과서열 5 사이의디술피드결합에의해안정화되고, 상기폴리펩티드또는단편은서열 2의 10개내지 14개아미노산, 서열 3의 14개내지 17개아미노산, 서열 4의 13개내지 18개아미노산, 및서열 5의 8개내지 12개잔기를포함할수있으며, 상기폴리펩티드또는단편은서열 2, 서열 3, 서열 4 및서열 5를포함할수있다. 본발명은인간스클레로스틴에특이적으로결합하는항체를제공한다. 상기항체는본원에개시된 1종이상의항체가인간스클레로스틴에결합하는것을교차-차단하는능력, 및 / 또는인간스클레로스틴이본원에개시된 1 종이상의항체에의해결합되는것을교차-차단하는능력을특징으로한다. 또한, 본발명은포유동물에서골형성, 골무기질밀도, 골무기질함량, 골질량, 골질및골강도중 1종이상을증가시킬수있는단리된항체또는그의항원-결합단편을제공한다. 또한, 본발명은세포기재의무기질침착검정에서스클레로스틴의억제효과를차단할수있는단리된항체또는그의항원-결합단편을제공한다. 또한, 본발명은인간스클레로스틴에특이적으로결합하고, 서열 39, 서열 40, 서열 41, 서열 42, 서열 43, 서열 44, 서열 45, 서열 46, 서열 47, 서열 48, 서열 49, 서열 50, 서열 51, 서열 52, 서열 53, 서열 54, 서열 55, 서열 56, 서열 57, 서열 58, 서열 59, 서열 60, 서열 61, 서열 62, 서열 78, 서열 79, 서열 80, 서열 81, 서열 99, 서열 100, 서열 101, 서열 102, 서열 103, 서열 104, 서열 105, 서열 106, 서열 107, 서열 108, 서열 109, 서열 110, 서열 111, 서열 112, 서열 113, 서열 114, 서열 115, 서열 116, 서열 237, 서열 238, 서열 239, 서열 240, 서열 241, 서열 242, 서열 243, 서열 244, 서열 245, 서열 246, 서열 247, 서열 248, 서열 249, 서열 250, 서열 251, 서열 252, 서열 253, 서열 254, 서열 255, 서열 256, 서열 257, 서열 258, 서열 259, 서열 260, 서열 261, 서열 262, 서열 263, 서열 264, 서열 265, 서열 266, 서열 267, 서열 268, 서열 269, 서열 270, 서열 271, 서열 272, 서열 273, 서열 274, 서열 275, 서열 276, 서열 277, 서열 278, 서열 279, 서열 280, 서열 281, 서열 282, 서열 283, 서열 284, 서열 285, 서열 286, 서열 287, 서열 288, 서열 289, 서열 290, 서열 291, 서열 292, 서열 293, 서열 294, 서열 295, 서열 296, 서열 297, 서열 298, 서열 351, 서열 352, 서열 353, 서열 358, 서열 359 및서열 360, 및이들의변이체로부터선택된 1개이상의 CDR 서열을갖는결합제, 예를들어항체를제공하며, 상기항체또는그의항원-결합단편은스클레로스틴을중화시킨다. 또한, 본발명은인간스클레로스틴에특이적으로결합하고, 서열 39, 서열 40, 서열 41, 서열 42, 서열 43, 서열 44, 서열 45, 서열 46, 서열 47, 서열 48, 서열 49, 서열 50, 서열 51, 서열 52, 서열 53, 서열 54, 서열 55, 서열 56, 서열 57, 서열 58, 서열 59, 서열 60, 서열 61, 서열 62, 서열 78, 서열 79, 서열 80, 서열 81, 서열 99, 서열 100, 서열 101, 서열 102, 서열 103, 서열 104, 서열 105, 서열 106, 서열 107, 서열 108, 서열 109, 서열 110, 서열 111, 서열 112, 서열 113, 서열 114, 서열 115, 서열 116, 서열 237, 서열 238, 서열 239, 서열 240, 서열 241, 서열 242, 서열 243, 서열 244, 서열 245, 서열 246, 서열 247, 서열 248, 서열 249, 서열 250, 서열 251, 서열 252, 서열 253, 서열 254, 서열 255, 서열 256, 서열 257, 서열 258, 서열 259, 서열 260, 서열 261, 서열 262, 서열 263, 서열 264, 서열 265, 서열 266, 서열 267, 서열 268, 서열 269, 서열 270, 서열 271, 서열 272, 서열 273, 서열 274, 서열 275, 서열 276, 서열 277, 서열 278, 서열 279, 서열 280, 서열 281, 서열 282, 서열 283, 서열 284, 서열 285, 서열 286, 서열 287, 서열 288, 서열 289, 서열 290, 서열 291, 서열 292, 서열 293, 서열 294, 서열 295, 서열 296, 서열 297, 서열 298, 서열 351, 서열 352, 서열 353, 서열 358, 서열 359 및서열 360, 및이들의변이체로부터선택된 1개이상의 CDR 서열을갖는결합제, 예를들어항체를제공한다
14 [0070] [0071] 또한, 본발명은인간스클레로스틴에서상기단백질의생체내활성에중요한영역을제공한다. 본발명의이러한측면및다른측면은하기하는발명의상세한설명및첨부된도면을참조로할때명백해질것이다. 본원에개시된모든참조문헌은, 이들각각이개별적으로포함된것과같이그전문이본원에참조로포함된다. [0072] 발명의효과 본발명은스클레로스틴단백질의에피토프및스클레로스틴결합제, 예를들면스클레로스틴과결합할수있는 항체와관련된조성물및방법을제공한다. [0073] 도면의간단한설명 도 1 은항 - 인간스클레로스틴및항 - 마우스스클레로스틴항체 Ab-A 에대한경쇄 ( 도 1A) ( 서열 23) 및중쇄 ( 도 1B) ( 서열 27) 의성숙형태의아미노산서열 ( 신호펩티드는절단됨 ) 을도시한다. 도 2는항-인간스클레로스틴및항-마우스스클레로스틴항체 Ab-B에대한경쇄 ( 도 2A) ( 서열 31) 및중쇄 ( 도 2B) ( 서열 35) 의성숙형태의아미노산서열 ( 신호펩티드는절단됨 ) 을도시한다. 도 3은항-인간스클레로스틴및항-마우스스클레로스틴항체 Ab-C에대한경쇄 ( 도 3A) ( 서열 15) 및중쇄 ( 도 3B) ( 서열 19) 의성숙형태의아미노산서열 ( 신호펩티드는절단됨 ) 을도시한다. 도 4는항-인간스클레로스틴및항-마우스스클레로스틴항체 Ab-D에대한경쇄 ( 도 4A) ( 서열 7) 및중쇄 ( 도 4B) ( 서열 11) 의성숙형태의아미노산서열 ( 신호펩티드는절단됨 ) 을도시한다. 도 5는마우스에서비히클, PTH (1-34), Ab-A 또는 Ab-B 처치 3주후에 2개의골격부위 ( 요추및경골의골간단 ( 骨幹端 )) 에서측정한골무기질밀도를도시한다. 도 6은마우스에서비히클, PTH (1-34) 또는 Ab-C 처치 2주후에 2개의골격부위 ( 요추및경골의골간단 ) 에서측정한골무기질밀도를도시한다. 도 7은마우스에서비히클또는 Ab-D 처치 3주후에 2개의골격부위 ( 요추및경골의골간단 ) 에서측정한골무기질밀도를도시한다. 도 8은인간스클레로스틴의성숙형태의아미노산서열 ( 신호펩티드는절단됨 ) ( 서열 1) 을도시한다. 또한, 인간스클레로스틴의성숙형태를코딩하는인간스클레로스틴코딩영역의뉴클레오티드서열도도시한다. 8 개의시스테인에는 C1 내지 C8의번호가매겨져있다. 시스틴-노트는 3개의디술피드결합 (C1-C5, C3-C7, C4- C8) 에의해형성된다. C2와 C6도디술피드결합을형성하지만, 이디술피드는시스틴-노트의일부가아니다. 도 9는인간스클레로스틴의기본구조에대한모식도를도시한다. N-말단아암 (arm) ( 첫번째 Q부터 C1까지 ) 및 C-말단아암 (C8부터말단 Y까지 ) 이있다. 이들아암사이에는시스틴-노트구조 (3개의디술피드에의해형성됨 : C1-C5, C3-C7, C4-C8) 및루프 1, 루프 2 및루프 3으로기재한 3개의루프가있다. 루프 1 및루프 3의원위영역은 C2-C6 디술피드에의해연결되어있다. 잠재적인트립신절단부위가표시되어있다 ( 아르기닌 = R 및리신 = K). 잠재적인 AspN 절단부위중일부가표시되어있다 ( 아스파르트산 (D) 잔기만을나타냄 ). 도 10은트립신또는 AspN 소화후인간스클레로스틴의 HPLC 펩티드맵을도시한다. 트립신소화에의해생성된인간스클레로스틴펩티드 (T19.2, T20, T20.6 및 T21-22) 및 AspN 소화에의해생성된인간스클레로스틴펩티드 (AspN14.6, AspN18.6 및 AspN ) 가표시되어있다. 도 11은트립신소화에의해생성된, 단리된인간스클레로스틴디술피드연결된펩티드에관한서열및질량정보를도시한다. Seq. pos. = 서열위치. Obs. = 관찰치. 관찰된질량은 ESI-LC-MS 분석으로결정하였다. 도 12는 AspN 소화에의해생성된, 단리된인간스클레로스틴펩티드에관한서열및질량정보를도시한다. AspN 펩티드는 4개의디술피드결합을함유한다. Seq. pos. = 서열위치. Obs. = 관찰치. 관찰된질량은 ESI-LC-MS 분석으로결정하였다. 도 13은트립신소화에의해생성된 4종의인간스클레로스틴펩티드 (T19.2, T20, T20.6 및 T21-22) 의선형모식도를보여준다
15 도 14는 AspN 소화에의해생성된 5종의인간스클레로스틴펩티드 (AspN14.6, AspN18.6 및 AspN ) 의선형모식도를보여준다. AspN14.6 HPLC 피크는어떠한디술피드결합으로도연결되지않은 3개의펩티드로구성된다. 도 15는비아코어 (Biacore)-기재의 " 인간스클레로스틴펩티드에피토프경쟁결합검정 " 으로부터의공명단위 (Ru, Resonance Unit) 신호를보여준다. 각종인간스클레로스틴-펩티드 ( 용액중 ) 에대한상대적 Mab 결합대 (vs.) 무손상성숙형태인간스클레로스틴 ( 비아코어칩상에고정화됨 ) 에대한 Mab 결합을평가하였다. 나타낸데이타는 Ab-A에대한것이다. 사용된인간스클레로스틴펩티드는 T19.2, T20, T20.6, T21-22, AspN14.6, AspN18.6 및 AspN 였다. 도 16은비아코어-기재의 " 인간스클레로스틴펩티드에피토프경쟁결합검정 " 으로부터의공명단위 (Ru) 신호를보여준다. 각종인간스클레로스틴-펩티드 ( 용액중 ) 에대한상대적 Mab 결합대무손상성숙형태인간스클레로스틴 ( 비아코어칩상에고정화됨 ) 에대한 Mab 결합을평가하였다. 나타낸데이타는 Ab-B에대한것이다. 사용된인간스클레로스틴펩티드는 T19.2, T20, T20.6, T21-22, AspN14.6, AspN18.6 및 AspN 였다. 도 17은비아코어-기재의 " 인간스클레로스틴펩티드에피토프경쟁결합검정 " 으로부터의공명단위 (Ru) 신호를보여준다. 각종인간스클레로스틴-펩티드 ( 용액중 ) 에대한상대적 Mab 결합대무손상성숙형태인간스클레로스틴 ( 비아코어칩상에고정화됨 ) 에대한 Mab 결합을평가하였다. 나타낸데이타는 Ab-C에대한것이다. 사용된인간스클레로스틴펩티드는 T19.2, T20, T20.6, T21-22, AspN14.6, AspN18.6 및 AspN 였다. 도 18은비아코어-기재의 " 인간스클레로스틴펩티드에피토프경쟁결합검정 " 으로부터의공명단위 (Ru) 신호를보여준다. 각종인간스클레로스틴-펩티드 ( 용액중 ) 에대한상대적 Mab 결합대무손상성숙형태인간스클레로스틴 ( 비아코어칩상에고정화됨 ) 에대한 Mab 결합을평가하였다. 나타낸데이타는 Ab-D에대한것이다. 사용된인간스클레로스틴펩티드는 T19.2, T20, T20.6, T21-22, AspN14.6, AspN18.6 및 AspN 였다. 도 19는인간스클레로스틴의 2개의 Mab 결합에피토프를보여준다. 도 19A는인간스클레로스틴에대한 Ab-A 및 Ab-B의결합에관여하는루프 2 에피토프의서열을보여준다 ( 서열 6). 도 19B는인간스클레로스틴에대한 Ab-C 및 Ab-D 결합에관여하는 T20.6 에피토프의서열, 디술피드결합및이의모식도를보여준다 ( 서열 2 내지서열 5). 도 20은트립신소화후인간스클레로스틴의 HPLC 펩티드맵을도시한다. 도 20A는인간스클레로스틴 Ab-D 복합체의소화를보여준다. 도 20B는인간스클레로스틴단독의소화를보여준다. T19.2, T20, T20.6 및 T21-22 펩티드피크가표시되어있다. 도 21은인간스클레로스틴에대한 Ab-D 결합에관여하는 "T20.6 유도체 1 ( 시스틴-노트 + 4개의아암 )" 에피토프의서열, 디술피드결합및이의모식도를보여준다 ( 서열 70 내지서열 73). 도 22는항-스클레로스틴중화 Mab 동정에이용된 MC3T3-E1-BF 골모세포세포주무기질침착검정의결과를보여준다. 마우스스클레로스틴 (Scl) 은 1 μg /ml로사용되었다. 모노클로날항체는 10 및 5 μg /ml로사용되었다. 무기질침착 ( 여러유형의불용성인산칼슘 ) 의정도는칼슘측정으로정량화하였다. 도 23은항-스클레로스틴중화 Mab 동정에이용된 MC3T3-E1-BF 골모세포세포주무기질침착검정의결과를보여준다. 인간스클레로스틴 (Scl) 은 1 μg /ml로사용되었다. 모노클로날항체는 8 및 4 μg /ml로사용되었다. 무기질침착 ( 여러유형의불용성인산칼슘 ) 의정도는칼슘측정으로정량화하였다. 도 24는항-스클레로스틴중화 Mab 동정에이용된 MC3T3-E1-BF 골모세포세포주무기질침착검정의결과를보여준다. 인간스클레로스틴 (Scl) 은 1 μg /ml로사용되었다. 모노클로날항체는 10 μg /ml로사용되었다. 무기질침착 ( 여러유형의불용성인산칼슘 ) 의정도는칼슘측정으로정량화하였다. 도 25는염증-유도된골소실 SCID 마우스모델의결과를도시한다. Ab-A 처치는전체골무기질밀도 ( 도 25A), 척추골밀도 ( 도 25B) 및대퇴골밀도 ( 도 25C) 로측정시에대장염과관련이있는염증-관련골소실로부터마우스를보호하였다. [0074] 발명을실시하기위한구체적인내용본발명은전장스클레로스틴에도결합하는항체에의해인식되는에피토프를함유하는인간스클레로스틴단백질영역, 및이들에피토프의제조및사용방법에관한것이다. 본발명은또한스클레로스틴또는스클레로스틴의일부에특이적으로결합하는결합제 ( 예를들어항체 ), 및이러한결합제를이용한방법을제공한다
16 상기결합제는 1 종이상의리간드에대한인간스클레로스틴의결합을차단하거나방해하는데유용하다. [0075] [0076] [0077] [0078] [0079] [0080] [0081] 재조합인간스클레로스틴 /SOST는알앤드디시스템즈 (R&D Systems, 미국미네소타주미네아폴리스소재, 2006 카탈로그번호 1406-ST-025) 로부터구입할수있다. 추가로, 재조합마우스스클레로스틴 /SOST는알앤드디시스템즈 ( 미국미네소타주미네아폴리스소재, 2006 카탈로그번호 1589-ST-025) 로부터구입할수있다. 연구등급의스클레로스틴결합모노클로날항체는알앤드디시스템즈 ( 미국미네소타주미네아폴리스소재, 마우스모노클로날 : 2006 카탈로그번호 MAB1406, 래트모노클로날 : 2006 카탈로그번호 MAB1589) 로부터구입할수있다. 미국특허제6,395,511호및동제6,803,453호및미국특허공개제 호및동제 호는일반적으로항-스클레로스틴항체에관해언급한다. 본원에서사용된바와같이, 인간스클레로스틴이라는용어는서열 1의단백질및그의대립유전자변이체를포함한다. 스클레로스틴은, 스클레로스틴을코딩하는유전자로형질감염시킨 293T 숙주세포에서숙주세포배양액의여과된상등액을염구배의헤파린 HP 컬럼으로용출시켜정제할수있다. 양이온교환크로마토그래피를이용한제조및추가의정제는실시예 1 및실시예 2에기재되어있다. 본발명이결합제는본원에서정의한바와같은항체인것이바람직하다. 용어 " 항체 " 는무손상항체또는그의결합단편을지칭한다. 항체는완전항체분자 ( 예를들어폴리클로날항체, 모노클로날항체, 키메라항체, 인간화항체, 또는전장중쇄및 / 또는경쇄를갖는인간버전항체 ) 를포함하거나또는그의항원결합단편을포함할수있다. 항체단편으로는 F(ab')2, Fab, Fab', Fv, Fc 및 Fd 단편등이있고, 이것들은단일도메인항체, 단일-쇄항체, 맥스바디 (maxibody), 미니바디 (minibody), 인트라바디 (intrabody), 디아바디 (diabody), 트리아바디 (triabody), 테트라바디 (tetrabody), v-nar 및비스-scFv에혼입될수있다 ( 예를들어, 문헌 [Hollinger and Hudson, 2005, Nature Biotechnology, 23, 9, ] 참조 ). 피브로넥틴폴리펩티드모노바디 (monobody) 를비롯한항체폴리펩티드는미국특허제6,703,199호에도개시되어있다. 다른항체폴리펩티드는미국특허공개제2005/ 호에개시되어있으며, 이것은단일-쇄폴리펩티드이다. 항체로부터유래된항원결합단편은통상의방법에따라예를들어항체의단백질성가수분해, 예를들어온전한항체의펩신또는파파인소화로수득할수있다. 예를들어, 항체단편은펩신을이용하여항체를효소절단시켜, F(ab')2라불리는 5 S 단편을만들어생성될수있다. 상기단편은티올환원제를사용하여추가로절단하여, 3.5 S Fab' 1가단편을만들수있다. 임의로, 절단반응은디술피드연결부의절단으로인하여생성되는술피드릴기에대한차단기를사용하여수행될수있다. 별법으로, 파파인을사용한효소절단은 2개의 1 가 Fab 단편및 Fc 단편을직접생성한다. 이들방법은예를들어골덴버그 (Goldenberg) 의미국특허제 4,331,647호, 문헌 ([Nisonoff et al., Arch. Biochem. Biophys. 89:230, 1960], [Porter, Biochem. J. 73:119, 1959], [Edelman et al., in Methods in Enzymology 1:422 (Academic Press 1967)] 및 [Andrews, S.M. and Titus, J.A. in Current Protocols in Immunology (Coligan J.E., et al., eds), John Wiley & Sons, New York (2003). pages 및 2.10A A.5]) 에기재되어있다. 항체를절단하는다른방법, 예를들어중쇄를분리시켜 1가경쇄-중쇄단편 (Fd) 을형성하는방법, 단편의추가절단방법, 또는다른효소적, 화학적또는유전자조작기술도, 이들단편이무손상항체에의해인식되는항원에결합하는단편이라면이용될수있다. 항체단편은임의의합성단백질또는유전자조작된단백질일수도있다. 예를들어, 항체단편은경쇄가변영역으로구성된단리된단편, 중쇄및경쇄의가변영역으로구성된 "Fv" 단편, 경쇄및중쇄가변영역이펩티드링커로연결된재조합단일쇄폴리펩티드분자 (scfv 단백질 ) 등을포함한다. 또다른형태의항체단편은항체의 1개이상의상보성결정영역 (CDR) 을포함하는펩티드이다. CDR (" 최소인식단위 " 또는 " 초가변영역 " 이라고도불림 ) 은관심 CDR을코딩하는폴리뉴클레오티드를구축하여수득될수있다. 이러한폴리뉴클레오티드는예를들어항체-생성세포의 mrna를주형으로사용하여가변영역을합성하는폴리머라제연쇄반응으로제조된다 ( 예를들어, 문헌 ([Larrick et al., Methods: A Companion to Methods in Enzymology 2:106, 1991; Courtenay-Luck, "Genetic Manipulation of Monoclonal Antibodies," in Monoclonal Antibodies: Production, Engineering and Clinical Application, Ritter et al. (eds.), page 166 (Cambridge University Press 1995)] 및 [Ward et al., "Genetic Manipulation and Expression of Antibodies," in Monoclonal Antibodies: Principles and Applications, Birch et al., (eds.), page 137 (Wiley-Liss, Inc. 1995)]) 참조 ). 따라서, 한실시양태에서, 상기결합제는본원에기재한바와같은 CDR을 1개이상포함한다. 상기결합제는본원에기재한바와같은 CDR을 2개이상, 3개이상, 4개이상, 5개이상또는 6개이상포함할수있다. 상기
17 결합제는본원에기재한항체의가변영역도메인을 1개이상포함할수있다. 가변영역도메인은임의의크기또는임의의아미노산조성일수있고, 일반적으로인간스클레로스틴과의결합을담당하고 1개이상의프레임워크 (framework) 서열에인접하거나그의프레임에맞게 (in frame) 존재하는 1개이상의 CDR 서열, 예를들어 CDR-H1, CDR-H2, CDR-H3 및 / 또는본원에서구체적으로기재한경쇄 CDR을포함한다. 일반적인측면에서, 가변 (V) 영역도메인은이뮤노글로불린중쇄 (VH) 및 / 또는경쇄 (VL) 가변도메인의임의의적합한배열일수있다. 따라서, 예를들어 V 영역도메인은단량체일수있고 VH 도메인또는 VL 도메인일수있으며, 이것은하기하는바와같이인간스클레로스틴에적어도 M 이하의친화도로독립적으로결합할수있다. 별법으로, V 영역도메인은이량체일수있고 VH-VH, VH-VL 또는 VL-VL 이량체를함유할수있다. V 영역이량체는비-공유결합으로연결될수있는 1개이상의 VH쇄및 1개이상의 VL쇄를포함한다 ( 이하, Fv라고지칭함 ). 원한다면, 상기쇄는예를들어 2개의가변도메인사이의디술피드결합을통해직접공유결합커플링되거나또는링커, 예를들어펩티드링커를통해공유결합커플링되어, 단일쇄 Fv (scfv) 를형성할수있다. [0082] [0083] [0084] [0085] [0086] [0087] 가변영역도메인은임의의천연발생가변도메인또는그의조작된버전일수있다. 조작된버전이라는것은, 가변영역도메인이재조합 DNA 조작기술로생성되었음을의미한다. 이렇게조작된버전은예를들어특이적항체가변영역에서특이적항체의아미노산서열내또는그에대한삽입, 결실또는변화가일어난것을포함한다. 특별한예로는, 제1 항체로부터의 1개이상의 CDR 및임의로는 1개이상의프레임워크아미노산을함유하고, 나머지가변영역도메인은제2 항체로부터유래된것인조작된가변영역도메인등이있다. 가변영역도메인은 1개이상의다른항체도메인또는그의단편에 C-말단아미노산에서공유결합으로부착될수있다. 따라서, 예를들어가변영역도메인에존재하는 VH 도메인은이뮤노글로불린 CH1 도메인또는그의단편에연결될수있다. 유사하게, VL 도메인은 CK 도메인또는그의단편에연결될수있다. 이러한방식에서, 예를들어상기항체는항원결합도메인이, 결합된 VH 도메인및 VL 도메인이이들의 C-말단에서 CH1 및 CK 도메인각각에공유결합으로연결되어있는것을함유하는 Fab 단편일수있다. CH1 도메인은추가의아미노산으로연장되어, 예를들어 Fab' 단편에서발견되는것과같은힌지 (hinge) 영역또는힌지영역도메인의일부를제공하거나, 또는추가의도메인, 예를들어항체 CH2 및 CH3 도메인을제공할수있다. 본원에기재한바와같이, 결합제는이들 CDR 중 1개이상을포함한다. 예를들어, 1개이상의 CDR이공지된항체프레임워크영역 (IgG1, IgG2 등 ) 에혼입될수도있고, 또는적합한비히클에접합되어그의반감기를증대시킬수도있다. 적합한비히클로는 Fc, 폴리에틸렌글리콜 (PEG), 알부민, 트랜스페린등이있으나, 이에제한되지않는다. 이러한비히클및다른적합한비히클은당업계에공지되어있다. 이와같이접합된 CDR 펩티드는단량체형태, 이량체형태, 사량체형태또는다른형태로존재할수있다. 한실시양태에서, 1개이상의수용성중합체가결합제중 1개이상의특정위치, 예를들어아미노말단에서결합된다. 특정바람직한실시양태에서, 결합제는폴리에틸렌글리콜, 폴리옥시에틸렌글리콜또는폴리프로필렌글리콜등을포함하지만이에제한되지않는 1개이상의수용성중합체부착부를포함한다. 예를들어, 미국특허제 4,640,835호, 동제4,496,689호, 동제4,301,144호, 동제4,670,417호, 동제4,791,192호및동제4,179,337호를참조한다. 특정실시양태에서, 유도체결합제는모노메톡시-폴리에틸렌글리콜, 덱스트란, 셀룰로스또는다른탄수화물기재의중합체, 폴리-(N-비닐피롤리돈 )-폴리에틸렌글리콜, 프로필렌글리콜단독중합체, 폴리프로필렌옥시드 / 에틸렌옥시드공중합체, 폴리옥시에틸화폴리올 ( 예를들어, 글리세롤 ) 및폴리비닐알콜, 및또한이러한중합체들의혼합물중 1종이상을포함한다. 특정실시양태에서, 1개이상의수용성중합체는 1개이상의측쇄에무작위로부착된다. 특정실시양태에서, PEG는결합제, 예를들어항체의치료능이개선되도록작용할수있다. 이러한특정방법은예를들어미국특허제6,133,426호등에서논의되어있으며, 상기문헌은어떠한목적으로든본원에참고로포함된다. 본발명의결합제가 1개이상의아미노산치환을가질수있으나, 상기결합제는결합특이성을보유한다는것이인지될것이다. 따라서, 결합제구조에있어서의변형은본발명의범위에속한다. 이는, 결합제의스클레로스틴결합능을손상시키지않으며보존적또는비보존적일수있는아미노산치환을포함할수있다. 보존적아미노산치환은비-천연발생아미노산잔기를포함할수있으며, 이것은생물학적시스템에서의합성이아니라전형적으로화학적펩티드합성에의해혼입된다. 이들로는펩티드모방체 (peptidomimetics) 및기타역전되거나반전된형태의아미노산부분등이있다. 보존적아미노산치환은또한천연아미노산잔기를, 해당위치아미노산잔기의극성또는전하에영향이거의없거나전혀없도록하는표준잔기로치환하는것을포함할수도있다. 비-보존적치환은한클래스의아미노산또는아미노산모방체중의구성원을상이한물리적성질 ( 예를들어
18 크기, 극성, 소수성, 전하 ) 을갖는또다른클래스의구성원과교환하는것을포함할수있다. 이러한치환된 잔기는인간항체중에서비 - 인간항체와상동성인영역또는상기분자의비 - 상동성영역에도입될수있다. [0088] [0089] [0090] [0091] [0092] [0093] [0094] 또한, 당업자는원하는각아미노산잔기에서단일아미노산치환을함유하는시험변이체를생성할수있다. 이후, 상기변이체를당업자에게공지된활성검정으로스크리닝할수있다. 이러한변이체는적합한변이체에관한정보를모으는데이용될수있다. 예를들어, 특정아미노산잔기의변화가활성의파괴, 바람직하지못한활성감소, 또는부적합한활성을초래하는것이발견되었다면, 이러한변화를갖는변이체는배제될수있다. 즉, 이러한통상의실험으로부터모은정보를기초로하여, 당업자는추가의치환이단독으로또는다른돌연변이와함께배제되어야하는아미노산을쉽게결정할수있다. 당업자는공지의기술을이용하여본원에기재한폴리펩티드의적합한변이체를결정할수있다. 특정실시양태에서, 당업자는상기분자중에서활성에중요하다고여겨지지않는영역을표적으로함으로써활성파괴없이변화될수있는적합한영역을동정할수있다. 특정실시양태에서, 당업자는상기분자중에서유사한폴리펩티드중에보존된잔기및부분을동정할수있다. 특정실시양태에서, 생물학적활성또는구조에중요할수있는영역이라하더라도, 생물학적활성을파괴하지않거나폴리펩티드구조에부정적인영향을주지않는보존적아미노산치환을실시할수있다. 추가로, 당업자는유사한폴리펩티드에서활성또는구조에중요한잔기를확인하는구조-기능연구를검토할수있다. 이러한비교로부터, 당업자는단백질중에서유사한폴리펩티드에서의활성또는구조에중요한아미노산잔기에상응하는아미노산잔기의중요성을예측할수있다. 당업자는이러한예측된중요아미노산잔기에대하여화학적으로유사한아미노산치환을선택할수있다. 당업자는또한유사한폴리펩티드에서의구조와관련하여 3차원구조및아미노산서열을분석할수도있다. 이러한정보로부터, 당업자는항체의아미노산잔기정렬을그의 3차원구조와관련하여예측할수있다. 특정실시양태에서, 단백질의표면상에존재할것으로예측되는아미노산잔기는다른분자와의중요한상호작용에관여할수있기때문에, 당업자는이러한잔기에는근본적인변화가가해지지않도록선택할수있다. 수많은과학학술간행물이 2차구조예측에집중되어왔다. 문헌 ([Moult J., Curr. Op. in Biotech., 7(4): (1996)], [Chou et al., Biochemistry, 13(2): (1974)], [Chou et al., Biochemistry, 113(2): (1974)], [Chou et al., Adv. Enzymol. Relat. Areas Mol. Biol., 47: (1978)], [Chou et al., Ann. Rev. Biochem., 47: ] 및 [Chou et al., Biophys. J., 26: (1979)]) 을참조한다. 또한, 컴퓨터프로그램도 2차구조예측을보조하는데현재이용가능하다. 2차구조예측방법중하나는상동성모델링을기초로한다. 예를들어, 서열동일성이 30% 초과이거나또는유사성이 40% 초과인 2종의폴리펩티드또는단백질은흔히유사한구조적형태를갖는다. 단백질구조데이타베이스 (PDB) 의최근진보는폴리펩티드의구조또는단백질의구조내폴딩 (folding) 의잠재적수등을비롯하여 2차구조의증대된예측능을제공해왔다. 문헌 [Holm et al., Nucl. Acid. Res., 27(1): (1999)] 을참조한다. 주어진폴리펩티드또는단백질에는폴딩의수가제한되어있고, 일단결정적인수의구조가밝혀졌으면, 구조적예측이현저하게매우정확해질것임이제안된바있다 [Brenner et al., Curr. Op. Struct. Biol., 7(3): (1997)]. 2차구조를예측하는추가의방법은 " 트레딩 (threading)" ([Jones, D., Curr. Opin. Struct. Biol., 7(3): (1997)], [Sippl et al., Structure, 4(1):15-19 (1996)]), " 프로파일분석 " ([Bowie et al., Science, 253: (1991)], [Gribskov et al., Meth. Enzym., 183: (1990)], [Gribskov et al, Proc. Nat. Acad. Sci., 84(13): (1987)]) 및 " 진화적연결부 " ( 문헌 [Holm, 상기문헌 (1999)] 및 [Brenner, 상기문헌 (1997)] 참조 ) 등을포함한다. 특정실시양태에서, 결합제의변이체는, 모 (parent) 폴리펩티드의아미노산서열과비교할때글리코실화부위의수및 / 또는유형이변경되어있는글리코실화변이체를포함한다. 특정실시양태에서, 변이체는천연단백질보다더많거나더적은수의 N-연결글리코실화부위를포함한다. N-연결글리코실화부위는 Asn-X-Ser 또는 Asn-X-Thr ( 여기서, X로표시한아미노산잔기는프롤린이외의임의의아미노산잔기일수있음 ) 의서열을특징으로한다. 상기서열이생성되도록아미노산잔기를치환하는것은, N-연결탄수화물쇄가부가될수있는새로운잠재적부위를제공한다. 별법으로, 상기서열을없애는치환은기존의 N-연결탄수화물쇄를제거할것이다. 또한, 1개이상의 N-연결글리코실화부위 ( 전형적으로는천연발생의것 ) 가제거되고 1개이상의새로운 N-연결부위가생성되는 N-연결탄수화물쇄의재배열도제공된다. 추가의바람직한항체변이체는, 모아미노산서열과비교할때 1개이상의시스테인잔기가결실되거나또다른아미노산 ( 예를들어, 세린 ) 대신치환된시스테인변이체를포함한다. 시스테인변이체는항체가예를들어불용성봉입체 (inclusion body) 의
19 단리후생물학적활성형태로리폴딩되어야하는경우에유용할수있다. 시스테인변이체는일반적으로천연 단백질보다시스테인잔기의수가적고, 전형적으로는쌍을이루지않은시스테인으로인한상호작용이최소화 되도록짝수이다. [0095] [0096] [0097] [0098] [0099] [0100] [0101] 원하는아미노산치환 ( 보존적치환또는비-보존적치환 ) 은당업자가이러한치환을원하는시기에결정할수있다. 특정실시양태에서, 아미노산치환은스클레로스틴에대한항체의중요잔기를동정하거나, 본원에기재한스클레로스틴항체의친화도를증가시키거나감소시키는데이용될수있다. 특정실시양태에따라서, 바람직한아미노산치환은 (1) 단백질분해에대한감수성을감소시키는치환, (2) 산화에대한감수성을감소시키는치환, (3) 단백질복합체를형성하는결합친화도를변경시키는치환, (4) 결합친화도를변경시키는치환, 및 / 또는 (4) 이러한폴리펩티드에다른물리화학적성질또는기능적성질을부여하거나그러한성질을변형시키는치환이다. 특정실시양태에따라, 단일또는다중아미노산치환 ( 특정실시양태에서, 보존적아미노산치환 ) 은천연발생서열 ( 특정실시양태에서는분자간접촉부를형성하는도메인 ( 들 ) 바깥쪽의폴리펩티드부분중의천연발생서열 ) 에서이루어질수있다. 특정실시양태에서, 보존적아미노산치환은전형적으로모서열의구조적특징을실질적으로변화시키지않는것일수있다 ( 예를들어, 대체아미노산이모서열중의나선을파괴하거나모서열에특징적인다른유형의 2차구조를파괴하는경향이있어서는안됨 ). 당업계에서인식되는폴리펩티드 2차및 3차구조의예는문헌 ([Proteins, Structures and Molecular Principles (Creighton, Ed., W. H. Freeman and Company, New York (1984))], [Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, N. Y. (1991))] 및 [Thornton et al. Nature 354:105 (1991)]) 에기재되어있으며, 상기문헌각각은본원에참고로포함된다. 특정실시양태에서, 본발명의결합제는중합체, 지질또는다른부분과화학적으로결합될수있다. 상기결합제는생체적합성프레임워크구조에혼입된, 본원에기재한 CDR 중 1개이상을포함할수있다. 한예에서, 생체적합성프레임워크구조는국소화된표면영역에서항원에결합하는 1종이상의아미노산서열 ( 예를들어, CDR, 가변영역등 ) 을디스플레이할수있는, 형태적으로안정한구조적지지체또는프레임워크또는스캐폴드 (scaffold) 를형성하기에충분한폴리펩티드또는그의일부를포함한다. 이러한구조는천연발생폴리펩티드또는폴리펩티드 " 폴드 (fold)" ( 구조적모티프 ) 일수도있고, 또는천연발생폴리펩티드또는폴드에대하여 1개이상의변형, 예를들어아미노산의부가, 결실또는치환을가질수도있다. 이들스캐폴드는임의의종 ( 또는 1종초과의종 ), 예를들어인간, 다른포유동물, 다른척추동물, 무척추동물, 식물, 박테리아또는바이러스의폴리펩티드에서유래된것일수있다. 전형적으로, 생체적합성프레임워크구조는이뮤노글로불린도메인이외의단백질스캐폴드또는골격을기초로한다. 예를들어, 피브로넥틴, 안키린, 리포칼린, 네오카르지노스타인, 사이토크롬 b, CP1 아연핑거 (zinc finger), PST1, 코일링된코일 (coiled coil), LACI-D1, Z 도메인및텐드라미사트도메인을기초로하는것이사용될수있다 ( 예를들어, 문헌 [Nygren and Uhlen, 1997, Current Opinion in Structural Biology, 7, ] 참조 ). 바람직한실시양태에서, 본발명의결합제가본원에기재한인간화항체를포함한다는것이인지될것이다. 예를들어본원에기재한것과같은인간화항체는당업자에게공지된기술을이용하여제조될수있다 ([Zhang, W., et al., Molecular Immunology. 42(12): , 2005], [Hwang W. et al., Methods. 36(1):35-42, 2005], [Dall'Acqua WF, et al., Methods 36(1):43-60, 2005] 및 [Clark, M., Immunology Today. 21(8): , 2000]). 추가로, 당업자는적합한결합제가이들항체의일부, 예를들어본원에서구체적으로개시한바와같은 CDR- H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 및 CDR-L3 중 1개이상을포함한다는것을인식할것이다. CDR-H1, CDR- H2, CDR-H3, CDR-L1, CDR-L2 및 CDR-L3 중 1개이상의영역은 1개이상의아미노산치환을가질수있지만, 상기결합제는비-치환된 CDR의결합특이성을보유한다. 상기결합제의비-CDR 부분은비-단백질분자일수있고, 이때의결합제는본원에개시된항체가스클레로스틴에결합하는것을교차-차단하고 / 하거나스클레로스틴을중화시킨다. 상기결합제의비-CDR 부분은비-단백질분자일수있고, 이때의결합제는 " 인간스클레로스틴펩티드에피토프경쟁결합검정 " 에서인간스클레로스틴펩티드에대하여발휘하는결합패턴이항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중 1종이상이발휘하는결합패턴과유사하고 / 하거나스클레로스틴을중화시킨다. 상기결합제의비-CDR 부분은아미노산으로이루어질수있고, 이때의결합제는재조합결합단백질또는합성펩티드이며, 상기재조합결합단백질은본원에개시
20 된항체가스클레로스틴에결합하는것을교차-차단하고 / 하거나스클레로스틴을중화시킨다. 상기결합제의비 -CDR 부분은아미노산으로이루어질수있고, 이때의결합제는재조합결합단백질이며, 상기재조합결합단백질은인간스클레로스틴펩티드에피토프경쟁결합검정 ( 하기함 ) 에서인간스클레로스틴펩티드에대하여발휘하는결합패턴이항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중 1종이상이발휘하는결합패턴과유사하고 / 하거나스클레로스틴을중화시킨다. [0102] [0103] [0104] [0105] 항체가상기한바와같이 CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 및 CDR-L3 중 1개이상을포함하는경우, 이것은이들서열을코딩하는 DNA를함유하는숙주세포로부터의발현에의해수득될수있다. 각 CDR 서열을코딩하는 DNA는 CDR의아미노산서열을기초로결정될수있고, 적절한경우에는올리고뉴클레오티드합성기술, 부위-지정돌연변이유발및폴리머라제연쇄반응 (PCR) 기술을이용하여임의의원하는항체가변영역프레임워크및불변영역 DNA 서열과함께합성될수있다. 가변영역프레임워크및불변영역을코딩하는 DNA는유전자서열데이타베이스, 예를들어진뱅크 (GenBank) 로부터당업자에게널리이용가능하다. 상기언급한 CDR 각각은전형적으로가변영역프레임워크에서캐버트 (Kabat) 넘버링시스템 [Kabat et al., 1987 in 서열 of Proteins of Immunological Interest, U.S. Department of Health and Human Services, NIH, USA] 에따라중쇄의위치 31 내지 35 (CDR-H1), 50 내지 65 (CDR-H2) 및 95 내지 102 (CDR-H3) 및경쇄의위치 24 내지 34 (CDR-L1), 50 내지 56 (CDR-L2) 및 89 내지 97 (CDR-L3) 에위치할것이다. 본발명의항체또는그의단편을코딩하는 DNA가일단합성되면, 이것은임의의수의공지의발현벡터를이용하여핵산절단, 라이게이션, 형질전환및형질감염과관련한임의의각종공지의절차에따라복제되어발현될수있다. 따라서, 특정실시양태에서, 항체단편의발현은원핵숙주, 예를들어에쉐리히아콜라이 (Escherichia coli) 에서선호될수있다 ( 예를들어문헌 [Pluckthun et al., 1989 Methods Enzymol. 178: ] 참조 ). 특정다른실시양태에서, 항체또는그의단편의발현은효모 ( 예를들어, 사카로마이세스세레비지애 (Saccharomyces cerevisiae), 쉬조사카로마이세스폼베 (Schizosaccharomyces pombe) 및피치아파스토리스 (Pichia pastoris)), 동물세포 ( 예를들어포유동물세포 ) 또는식물세포등을비롯한진핵숙주세포에서선호될수있다. 적합한동물세포의예로는골수종 ( 예를들어마우스 NSO 세포주 ), COS, CHO 또는하이브리도마세포등이있으나, 이에제한되지않는다. 식물세포의예로는담배세포, 옥수수세포, 대두세포및벼세포등이있다. 항체가변영역및 / 또는불변영역을코딩하는 DNA를함유하는 1개이상의복제가능한발현벡터를제조하고, 이것을이용하여항체가생성될적절한세포주, 예를들어비-생성골수종세포주, 예를들어마우스 NSO 세포주또는박테리아, 예를들어이. 콜라이 (E. coli) 를형질감염시킬수있다. 효율적인전사및번역달성을위해서는, 각벡터중의 DNA 서열이가변도메인서열에작동가능하게연결된적절한조절서열, 특히프로모터및리더서열을포함해야한다. 이러한방법으로항체를생성하는특별한방법은일반적으로공지되어있으며통상적으로사용되고있다. 예를들어, 기본적인분자생물학절차는문헌 [Maniatis et al., Molecular Cloning, A Laboratory Manual, 2nd ed., Cold Spring Harbor Laboratory, New York, 1989] 또한문헌 [Maniatis et al., 3rd ed., Cold Spring Harbor Laboratory, New York, (2001)] 에기재되어있다. DNA 서열결정은문헌 ([Sanger et al., PNAS 74:5463, (1977)] 및 [Amersham International plc sequencing handbook]) 에기재된바와같이수행할수있고, 부위-지정돌연변이유발은당업계에공지된방법 ([Kramer et al., Nucleic Acids Res. 12:9441, (1984)], [Kunkel Proc. Natl. Acad. Sci. USA 82: (1985)], [Kunkel et al., Methods in Enzymol. 154: (1987), the Anglian Biotechnology Ltd handbook]) 에따라수행할수있다. 추가로, 수많은간행물이 DNA 조작, 발현벡터의제작, 및적절한세포의형질전환및배양에의한항체제조에적합한기술을기재한다 ([Mountain A and Adair, J R in Biotechnology and Genetic Engineering Reviews (ed. Tombs, M P, 10, Chapter 1, 1992, Intercept 및over, UK)], ["Current Protocols in Molecular Biology", 1999, F.M. Ausubel (ed.), Wiley Interscience, New York]). 상기언급한 CDR 중 1개이상을함유하는본발명에따른항체의친화도를개선시키고자하는경우, 이는 CDR 유지 [Yang et al., J. Mol. Biol, 254, , 1995], 쇄셔플링 (shuffling) [Marks et al., Bio/Technology, 10, , 1992], 이. 콜라이돌연변이균주의사용 [Low et al., J. Mol. Biol, 250, , 1996], DNA 셔플링 [Patten et al., Curr. Opin. Biotechnol, 8, , 1997], 파지디스플레이 [Thompson et al., J. MoI Biol, 256, 7-88, 1996] 및성적 (sexual) PCR [Crameri, et al., Nature, 391, , 1998] 등을비롯한수많은친화도성숙프로토콜로달성할수있다. 이들친화도성숙방법모두가문헌 [Vaughan et al., Nature Biotechnology, 16, , 1998] 에논의되어있다
21 [0106] [0107] [0108] 본발명에따른다른항체는본원에기재하고당업계에공지된바와같은통상의면역화및세포융합절차로수득될수있다. 본발명의모노클로날항체는각종공지기술을이용하여생성될수있다. 일반적으로, 특이적항원에결합하는모노클로날항체는당업자에게공지된방법으로수득될수있다 ( 예를들어, 문헌 [Kohler et al., Nature 256:495, 1975], [Coligan et al. (eds.), Current Protocols in Immunology, 1: (John Wiley & Sons 1991)], 미국특허제RE 32,011호, 동제4,902,614호, 동제4,543,439호및동제 4,411,993호, [Monoclonal Antibodies, Hybridomas: A New Dimension in Biological Analyses, Plenum Press, Kennett, McKearn 및 Bechtol (eds.) (1980)] 및 [Antibodies: A Laboratory Manual, Harlow and Lane (eds.), Cold Spring Harbor Laboratory Press (1988)], [Picksley et al., "Production of monoclonal antibodies against proteins expressed in E. coli," in DNA Cloning 2: Expression Systems, 2nd Edition, Glover et al. (eds.), page 93 (Oxford University Press 1995)]). 항체단편은임의의적합한표준기술, 예를들어단백질분해소화또는임의로는단백질분해소화 ( 예를들어, 파파인또는펩신사용 ) 후의디술피드결합의온화한환원및알킬화등을이용하여유도될수있다. 별법으로, 이러한단편은본원에기재한바와같은재조합유전자조작기술로생성될수도있다. 당업계에공지되고본원에기재된방법에따라, 모노클로날항체는당업계에공지된바와같이동물, 예를들어래트, 햄스터, 토끼, 또는바람직하게는마우스, 예를들어트랜스제닉또는넉-아웃 (knock-out) 에게서열 1의인간스클레로스틴또는그의단편을포함하는면역원을주입하여수득될수있다. 특이적항체생성의여부는초기주입후및 / 또는부스터주입후에당업계에공지되고본원에기재된여러가지면역검출방법중임의의것을이용하여혈청샘플을수득하고인간스클레로스틴또는펩티드에결합하는항체의존재를검출하여모니터링할수있다. 원하는항체를생성하는동물로부터, 림프양세포, 가장통상적으로는비장또는림프절의세포를꺼내어 B-림프구를수득한다. 이어서, 상기 B 림프구를약물-감작화된골수종세포융합파트너, 바람직하게는면역화된동물과동계 (syngeneic) 이고임의로는바람직한기타성질 ( 예를들어, 내인성 Ig 유전자생성물, 예컨대 P3X63-Ag (ATCC 번호 : CRL 1580), NSO, SP20의발현불능 ) 을보유하는것과융합시켜, 불멸진핵세포주인하이브리도마를생성한다. 림프양 ( 예를들어비장 ) 세포및골수종세포를수분동안막융합-촉진제, 예를들어폴리에틸렌글리콜또는비-이온성세정제와배합한후에하이브리도마세포의성장은지지하지만미융합골수종세포의성장은지지하지않는선별배지에낮은밀도로플레이팅할수있다. 바람직한선별배지는 HAT ( 하이포크산틴, 아미노프테린, 티미딘 ) 이다. 충분한시간후, 통상적으로는약 1주내지 2 주후, 세포콜로니가관찰된다. 단일콜로니를단리하고, 세포에의해생성된항체를당업계에공지되고본원에기재된각종면역검정법중임의의것을이용하여인간스클레로스틴에대한결합활성에대하여시험할수있다. 하이브리도마를클로닝하고 ( 예를들어제한희석클로닝또는연질아가플라크단리법을이용함 ), 스클레로스틴에특이적인항체를생성하는양성클론을선별하여배양한다. 하이브리도마배양액으로부터의모노클로날항체를하이브리도마배양액의상등액에서단리할수있다. 뮤린 (murine) 모노클로날항체를생성하는별법의방법은하이브리도마세포를동계마우스, 예를들어모노클로날항체를함유하는복수액의형성이촉진되도록처리된마우스 ( 예를들어, 프리스탄-프라이밍 (priming) 된마우스 ) 의복강내로주입하는것이다. 모노클로날항체는각종수립된기술로단리및정제될수있다. 이러한단리기술로는프로테인-A 세파로스 (Protein-A Sepharose) 를이용한친화도크로마토그래피, 크기-배제크로마토그래피및이온-교환크로마토그래피 ( 예를들어, 콜리간 (Coligan) 문헌의제2.7.1면내지제2.7.12면및제2.9.1면내지제2.9.3면, 문헌 [Baines et al., "Purification of Immunoglobulin G (IgG)," in Methods in Molecular Biology, Vol. 10, pages (The Humana Press, Inc. 1992)] 참조 ) 등이있다. 모노클로날항체는항체의특정성질 ( 예를들어, 중쇄또는경쇄이소형, 결합특이성등 ) 을기초로하여선택된적절한리간드를이용한친화도크로마토그래피로정제될수있다. 고체지지체상에고정된적합한리간드의예로는, 프로테인 A, 프로테인 G, 항-불변영역 ( 경쇄또는중쇄 ) 항체, 항-이디오타입 (idiotype) 항체, 및 TGF-베타결합단백질또는그의단편또는변이체등이있다. 본발명의항체는또한인간모노클로날항체일수도있다. 인간모노클로날항체는당업자에게친숙한임의의수의기술로생성될수있다. 이러한방법으로는, 인간말초혈세포 ( 예를들어, B 림프구함유 ) 의엡스테인바르바이러스 (EBV) 형질전환, 인간 B 세포의시험관내면역화, 삽입된인간이뮤노글로불린유전자를보유하는면역화된트랜스제닉마우스로부터의비장세포의융합, 인간이뮤노글로불린 V 영역파지라이브러리로부터의단리, 또는당업계에공지되고본원에서의개시내용을기초로하는기타절차등이있으나이에제한되지않는다. 예를들어, 인간모노클로날항체는항원성시험감염 (challenge) 에대한반응으로특이적인간항체를생성하도록조작된트랜스제닉마우스에서수득될수있다. 트랜스제닉마우스로부터인간항체를수득하는방법은예를들어문헌 ([Green et al., Nature Genet. 7:13, 1994], [Lonberg et al., Nature 368:856, 1994],
22 [Taylor et al., Int. Immun. 6:579, 1994], 미국특허제5,877,397호, [Bruggemann et al., 1997 Curr. Opin. Biotechnol. 8:455-58], [Jakobovits et al., 1995 Ann. N. Y. Acad. Sci. 764:525-35]) 에기재되어있다. 상기기술에서, 인간중쇄및경쇄유전자좌의요소가, 내인성중쇄및경쇄유전자좌의표적화된파괴를함유하는배아줄기세포주에서유래한마우스균주에도입된다 ( 또한, 문헌 [Bruggemann et al., Curr. Opin. Biotechnol. 8: (1997)] 참조 ). 예를들어, 인간이뮤노글로불린트랜스진 (transgene) 은미니-유전자구조물이거나또는마우스림프양조직에서 B 세포-특이적 DNA 재배열및과다돌연변이가일어난효모인공염색체상의트랜스유전자좌 (transloci) 일수있다. 인간모노클로날항체는트랜스제닉마우스를면역화하여수득될수있으며, 이것은이후에스클레로스틴에특이적인인간항체를생성할수있다. 면역화된트랜스제닉마우스의림프양세포는본원에기재된방법에따라인간항체-분비하이브리도마를제조하는데이용될수있다. 인간항체를함유하는폴리클로날혈청또한면역화된동물의혈액으로부터수득될수있다. [0109] [0110] [0111] [0112] [0113] 본발명의인간항체를생성하는또다른방법은 EBV 형질전환에의해인간말초혈세포를불멸화하는것을포함한다. 예를들어, 미국특허제4,464,456호를참조한다. 스클레로스틴에특이적으로결합하는모노클로날항체를생성하는이러한불멸화 B 세포주 ( 또는림프아구양세포주 ) 는본원에서제공하는바와같은면역검출방법, 예를들어 ELISA로동정된후에표준클로닝기술로단리될수있다. 항-스클레로스틴항체를생성하는림프아구양세포주의안정성은당업계에공지된방법에따라형질전환된세포주를뮤린골수종과융합하여마우스 -인간하이브리드세포주를생성함으로써개선될수있다 ( 예를들어문헌 [Glasky et al., Hybridoma 8: (1989)] 참조 ). 인간모노클로날항체를생성하는또다른방법은시험관내면역화이며, 이것은인간비장 B 세포를인간스클레로스틴으로프라이밍한후에프라이밍된 B 세포를헤테로하이브리드융합파트너와융합시키는것을포함한다. 예를들어문헌 [Boerner et al., 1991 J. Immunol. 147:86-95] 을참조한다. 특정실시양태에서, 당업계에공지되고 ( 제WO 92/02551호, 미국특허제5,627,052호, 문헌 [Babcook et al., Proc. Natl Acad. Sci. USA 93: (1996)]) 본원에기재된분자생물학기술에따라항-인간스클레로스틴항체를생성하는 B 세포가선별되고상기 B 세포로부터경쇄및중쇄가변영역이클로닝된다. 면역화된동물로부터의 B 세포는비장, 림프절또는말초혈샘플에서스클레로스틴에특이적으로결합하는항체를생성하고있는세포를선별하여단리될수있다. B 세포는인간, 예를들어말초혈샘플에서단리될수도있다. 원하는특이성을갖는항체를생성하는단일 B 세포의검출방법은당업계에공지되어있고, 예를들어플라크형성, 형광-활성화세포분류, 시험관내자극및이후특이적항체의검출등이있다. 특이적항체-생성 B 세포의선별방법으로는, 예를들어인간스클레로스틴을함유하는연질아가중 B 세포의단일세포현탁액제조등이있다. B 세포에의해생성된특이적항체가항원에결합하면복합체가형성되고, 이것은면역침전물로관찰될수있다. 원하는항체를생성하는 B 세포를선별한후, 당업계에공지되고본원에기재된방법에따라 DNA 또는 mrna를단리및증폭시켜특이적항체유전자를클로닝할수있다. 본발명의항체를수득하기위한추가의방법은파지디스플레이에의한것이다. 예를들어, 문헌 ([Winter et al., 1994 Annu. Rev. Immunol. 12:433-55], [Burton et al, 1994 Adv. Immunol. 57: ]) 을참조한다. 인간또는뮤린이뮤노글로불린가변영역유전자조합라이브러리는, TGF-베타결합단백질또는그의변이체또는단편에특이적으로결합하는 Ig 단편 (Fab, Fv, sfv 또는이들의다량체 ) 의선별을위해스크리닝될수있는파지벡터에서생성될수있다. 예를들어미국특허제5,223,409호, 문헌 ([Huse et al., 1989 Science 246: ], [Sastry et al., Proc. Natl. Acad. Sci. USA 86: (1989)], [Alting-Mees et al., Strategies in Molecular Biology 3:1-9 (1990)], [Kang et al., 1991 Proc. Natl Acad. Sci. USA 88: ], [Hoogenboom et al., 1992 J. Molec. Biol. 227: ], [Schlebusch et al., 1997 Hybridoma 16:47-52]) 및상기문헌에서인용된참조문헌을참조한다. 예를들어, Ig 가변영역단편을코딩하는복수개의폴리뉴클레오티드서열을함유하는라이브러리는섬유상박테리오파지, 예를들어 M13 또는그의변이체의게놈에파지외피단백질을코딩하는서열과프레임에맞게삽입될수있다. 융합단백질은경쇄가변영역도메인및 / 또는중쇄가변영역도메인과의외피단백질융합일수있다. 특정실시양태에따라, 이뮤노글로불린 Fab 단편은또한파지입자상에나타날수있다 ( 예를들어, 미국특허제5,698,426호참조 ). 중쇄및경쇄이뮤노글로불린 cdna 발현라이브러리는또한, 예를들어 λ이뮤노자프 (ImmunoZap)( 상표명 )(H) 및 λ이뮤노자프 ( 상표명 )(L) 벡터 ( 캘리포니아주라졸라소재스트라젠 (Sratagene)) 를사용하여 λ 파지내에서제조될수있다. 요약하면, mrna를 B 세포개체군으로부터단리하고, 이를사용하여 λ이뮤노자프 (H) 및 λ이뮤노자프 (L) 벡터내에중쇄및경쇄이뮤노글로불린 cdna 발현라이브러리를제조한다. 이들벡터는개별적으로스크리닝되거나공-발현되어 Fab 단편또는항체 ( 상기휴스 (Huse) 등의문헌및상기사스트리 (Sastry) 등
23 의문헌참조 ) 를형성할수있다. 이어서포지티브플라크를비 - 용해성플라스미드로전환하여이. 콜라이로부 터모노클로날항체단편이높은수준으로발현되도록할수있다. [0114] [0115] [0116] [0117] [0118] [0119] [0120] [0121] [0122] 한실시양태에서, 하이브리도마내의목적하는모노클로날항체를발현하는유전자의가변영역은뉴클레오티드프라이머를사용하여증폭된다. 이들프라이머는당업자에의해합성되거나, 시판되는공급원 ( 예를들어, 마우스및인간가변영역에대한프라이머, 및다른것들중에서 VHa, VHb, VHc, VHd, CH1, VL 및 CL 영역에대한프라이머를판매하는스트라젠 ( 캘리포니아주라졸라소재 )) 으로부터구입할수있다. 이들프라이머를사용하여중쇄또는경쇄가변영역을증폭시킬수있으며, 그후이들을벡터, 예컨대각각이뮤노자프 ( 상표명 )H 또는이뮤노자프 ( 상표명 )L ( 스트라젠 ) 내로삽입할수있다. 이들벡터는발현을위해이. 콜라이, 효모또는포유동물기재시스템내로도입될수있다. 이들방법을사용하여 VH 및 VL 도메인의융합을함유하는다량의단쇄단백질을제조할수있다 ( 문헌 [Bird et al., Science 242: , 1988] 참조 ). 임의의상기기술한면역화및다른기술을이용하여본발명에따른항체를제조하는세포를수득하고, 이로부터본원에기술된표준절차에따라 DNA 또는 mrna를단리하고증폭시킴으로써특정항체유전자를클로닝할수있다. 이로부터제조된항체를서열화하고, 확인된 CDR 및 CDR에대해코딩한 DNA를이전에기술한바와같이조작하여본발명에따른다른항체를발생시킬수있다. 바람직하게는, 상기결합제는구체적으로스클레로스틴에결합한다. 모든결합제및결합검정으로부터, 당업자는결합제가치료적으로유효하고적합해지기위해검출가능하게결합하지않아야하는다양한잔기가고갈되었고사용하기에비현실적임을인지하고있다. 그러므로, 본원에개시된결합제에대해, 용어 " 구체적으로결합한다 " 는결합제가관련되지않은제어단백질에결합하는것보다높은친화도로스클레로스틴, 바람직하게는인간스클레로스틴에결합하는결합제의능력을지칭한다. 바람직하게는, 제어단백질은계란흰자리소자임이다. 바람직하게는, 상기결합제는제어단백질에대한친화도보다 50, 100, 250, 500, 1000 또는 10,000배이상의친화도로스클레로스틴에결합한다. 결합제는인간스클레로스틴에대해 1 x 10-7M 이하, 1 x 10-8M 이하, 1 x 10-9M 이하, 1 x 10-10M 이하, 1 x 10-11M 이하또는 1 x 10-12M 이하의결합친화도를가질수있다. 친화도는친화도 ELISA 검정으로측정할수있다. 특정실시양태에서, 친화도는비아코어검정으로측정할수있다. 특정실시양태에서, 친화도는동력법으로측정할수있다. 특정실시양태에서, 친화도는평형 / 용액법으로측정할수있다. 상기방법은본원에보다자세히기술되어있거나, 또는당업계에공지되어있다. 바람직하게는, 본발명의스클레로스틴결합제는본원에기술된세포-기재검정및 / 또는본원에기술된생체내검정에서스클레로스틴기능을조절하고 / 거나본원에기술된하나이상의에피토프에결합하고 / 거나, 본명세서에기술된항체중하나에결합하는것을교차-차단하고 / 거나본명세서에기술된항체중하나에의해스클레로스틴과의결합으로부터교차-차단된다. 따라서, 상기결합제는본원에기술된검정을사용하여확인할수있다. 특정실시양태에서, 결합제는먼저본원에제공된하나이상의에피토프에결합하고 / 거나본원에기술된세포- 기재검정및 / 또는생체내검정으로중화되고 / 거나본명세서에기술된항체를교차-차단하고 / 거나본명세서에기술된하나이상의항체에의해스크레로스틴과의결합으로부터교차-차단됨으로써발생된다. 이어서, 이들항체의 CDR 영역을사용하여적절한생체적합한골격에삽입하여스클레로스틴결합제를발생시킨다. 상기결합제의비-CDR 부분은아미노산으로구성될수있거나, 또는비-단백질분자일수있다. 본원에기술된검정으로결합제를특성화할수있다. 바람직하게는, 본발명의결합제는본원에정의된바와같은항체이다. 당업자는일부단백질, 예컨대항체가다양한번역후개질을겪을수있음을이해할것이다. 이들개질의유형및정도는종종단백질을발현시키는데사용되는숙주세포주및배양조건에따라달라진다. 상기개질은글리코실화, 메티오닌산화, 디케토피페라진형성, 아스파테이트이성질체화및아스파라긴탈아미드화에서의변형을포함할수있다. 자주일어나는개질은카르복시펩티다제의작용으로인한카르복시-말단염기성잔기 ( 예컨대, 리신또는아르기닌 ) 의손실이다 ( 문헌 [Harris, RJ. Journal of Chromatography 705: , 199 5] 에기술된바와같음 ). Ab-A, Ab-B, Ab-C, Ab-D 및 Ab-1로서지칭되는항체를하기에나타내었다. "HC" 는중쇄를지칭하고, "LC" 는경쇄를지칭한다. 하기일부항체에대하여, CDR은어두운네모로표시하고, 불변 (C) 영역은두꺼운이탤릭체로표시하였다. Ab-D
24 [0123] [0124] 항체 D ( 본원에서 Ab-D 및 Mab-D 로도지칭됨 ) 는스클레로스틴에높은친화도로결합하는마우스항체이다. Ab- D 의비아코어결합패턴을도 18 에나타내었다. Ab-D 경쇄의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0125] [0126] Ab-D LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 [0127] [0128] 신호펩티드를포함하는 Ab-D LC 의아미노산서열은 이다. [0129] [0130] 신호펩티드코딩서열을포함하는 Ab-D LC 의핵산서열은 이다. [0131] [0132] Ab-D HC 중쇄의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 이다. [0133] [0134] Ab-D HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 이다
25 [0135] 이다. [0136] 신호펩티드를포함하는 Ab-D HC 의아미노산서열은 [0137] 이다. [0138] 신호펩티드코딩서열을포함하는 Ab-D HC 의핵산서열은 [0139] 이다. [0140] Ab-D 의중쇄가변영역내 CDR ( 상보성결정영역 ) 서열은 [0141] [0142] Ab-D 의경쇄가변영역내 CDR 서열은 이다
26 [0143] 이다. [0144] [0145] Ab-C 항체 C ( 본원에서 Ab-C 및 Mab-C로도지칭됨 ) 는스클레로스틴에높은친화도로결합하는마우스항체이다. Ab- C의비아코어결합패턴을도 17에나타내었다. Ab-C 경쇄의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 [0146] [0147] 이다. Ab-C LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 [0148] [0149] 신호펩티드를포함하는 Ab-C LC 의아미노산서열은 이다. [0150] [0151] 신호펩티드코딩서열을포함하는 Ab-C LC 의핵산서열은 이다. [0152] [0153] [0154] Ab-C 중쇄 Ab-C HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 이다. [0155] [0156] Ab-C HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 이다
27 [0157] 이다. [0158] 신호펩티드를포함하는 Ab-C HC 의아미노산서열은 [0159] 이다. [0160] 신호펩티드코딩서열을포함하는 Ab-C HC 의핵산서열은 [0161] 이다. [0162] Ab-C 의중쇄가변영역내 CDR ( 상보성결정영역 ) 서열은 [0163] 이다
28 [0164] Ab-C 의경쇄가변영역내 CDR 서열은 [0165] [0166] [0167] [0168] [0169] 이다. Ab-A 항체 A ( 본원에서 Ab-A 및 Mab-A로도지칭됨 ) 는스클레로스틴에높은친화도로결합하는토끼-마우스키메라항체이다. Ab-A의비아코어결합패턴을도 15에나타내었다. Ab-A 경쇄 Ab-A LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0170] [0171] Ab-A LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0172] [0173] 신호펩티드를포함하는 Ab-A LC 의아미노산서열은 [0174] 이다. [0175] 신호펩티드코딩서열을포함하는 Ab-A LC 의핵산서열은 [0176] 이다. [0177] Ab-A HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 [0178] 이다
29 [0179] Ab-A HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 [0180] 이다. [0181] 신호펩티드를포함하는 Ab-A HC 의아미노산서열은 [0182] 이다. [0183] 신호펩티드코딩서열을포함하는 Ab-A HC 의핵산서열은 [0184] 이다. [0185] Ab-A 의중쇄가변영역내 CDR ( 상보성결정영역 ) 서열은 [0186] 이다
30 [0187] Ab-A 의경쇄가변영역내 CDR 서열은 [0188] [0189] [0190] 이다. Ab-A 는인간화된것이고, 하기서열을갖는항체 1 ( 본원에서 Ab-1 로도지칭됨 ) 로지칭된다. 신호펩티드코딩서열을포함하는 Ab-1 LC 가변영역의핵산서열은 [0191] [0192] 신호펩티드를포함하는 Ab-1 LC 가변영역의아미노산서열은 이다. [0193] [0194] 신호펩티드코딩서열을포함하는 Ab-1 HC 가변영역의핵산서열은 이다. [0195] [0196] 신호펩티드를포함하는 Ab-1 HC 가변영역의아미노산서열은 이다. [0197] [0198] Ab-1 의중쇄가변영역내 CDR ( 상보성결정영역 ) 서열은 이다. [0199] [0200] Ab-1 의경쇄가변영역내 CDR 서열은 이다. [0201] [0202] [0203] [0204] [0205] 이다. Ab-B 항체 B ( 본원에서 Ab-B 및 Mab-B로도지칭됨 ) 는스클레로스틴에높은친화도로결합하는마우스항체이다. Ab-B 의비아코어결합패턴을도 16에나타내었다. Ab-B 경쇄 Ab-B LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 [0206] [0207] 이다. Ab-B LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은
31 [0208] 이다. [0209] 신호펩티드를포함하는 Ab-B LC 의아미노산서열은 [0210] 이다. [0211] 신호펩티드코딩서열을포함하는 Ab-B LC 의핵산서열은 [0212] 이다. [0213] [0214] Ab-B 중쇄 Ab-B HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 [0215] [0216] 이다. Ab-B HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은
32 [0217] 이다. [0218] 신호펩티드를포함하는 Ab-B HC 의아미노산서열은 [0219] 이다. [0220] 신호펩티드코딩서열을포함하는 Ab-B HC 의핵산서열은 [0221] 이다. [0222] Ab-B 의중쇄가변영역내 CDR ( 상보성결정영역 ) 서열은 [0223] [0224] Ab-B 의경쇄가변영역내 CDR 서열은 이다
33 [0225] [0226] [0227] [0228] [0229] [0230] [0231] [0232] [0233] 이다. 본원에개시된항체는단백질의생체내활성에중요한인간스클레로스틴의영역에결합한다. 항체와스클레로스틴의결합은, 예컨대실시예 5 및 9 ( 마우스 ) 및실시예 12 ( 원숭이 ) 에서기술된생체내항체의사용에의해달성되는골무기질밀도증가와관련될수있다. 골형성, 골무기질함량, 골질량, 골질및골강도중적어도하나의증가는또한, 예컨대실시예 5 및 9 ( 마우스 ) 및실시예 12 ( 원숭이 ) 에서기술된바와같은생체내항체의사용에의해달성될수있다. 항체와스클레로스틴의결합은주로이의 CDR 서열에의해결정되므로, 본발명을실행하기위한항체는적절한골격내에서개시된전체또는일부 CDR 서열로발생될수있으며, 여기서상기항체는스클레로스틴에구체적으로결합하는능력을보유하며, 예를들어골무기질밀도에서의증가를달성할것으로기대될수있다. 상기항체는낮은골형성, 낮은골무기질밀도, 낮은골무기질함량, 낮은골질량, 낮은골질및낮은골강도중적어도하나에의해야기되거나, 이와관련되거나또는이를발생시키는인간또는동물상태의치료에유용하다. 본발명의 CDR을포함하는항체및이의단편의구축및발현방법은당업자에게공지되어있다. 그러므로, 본발명은한실시양태에서 Ab-A를비롯한단리된항체, 또는이의항원결합단편에관한것이며, 이는구체적으로스클레로스틴에결합하고, 상기중쇄의가변도메인은 CDR-H1에대해서열 51, CDR-H2에대해서열 52, CDR-H3에대해서열 53에제시된서열을갖는적어도하나의 CDR을포함한다. 항체또는이의항원결합단편은 CDR이 CDR-H1에대해서열 51, CDR-H2에대해서열 52, CDR-H3에대해서열 53 중적어도하나의펩티드로이루어진중쇄가변도메인을포함할수있다. 본발명의항체내에경쇄가존재할경우, 상기경쇄는임의의적합한상보적사슬일수있고, 특히가변도메인이 CDR-L1에대해서열 54, CDR-L2에대해서열 55 및 CDR-L3에대해서열 56에제시된서열을갖는적어도하나의 CDR을포함하는경쇄로부터선택될수있다. 항체또는이의항원결합단편은 CDR이 CDR-L1에대해서열 54, CDR-L2에대해서열 55, CDR-L3에대해서열 56 중적어도하나의펩티드로이루어진경쇄가변도메인을포함할수있다. 본발명은또한 Ab-B를비롯한단리된항체, 또는이의항원결합단편에관한것이며, 이는구체적으로스클레로스틴에결합하고, 상기중쇄의가변도메인은 CDR-H1에대해서열 57, CDR-H2에대해서열 58, CDR-H3에대해서열 59에제시된서열을갖는적어도하나의 CDR을포함한다. 항체또는이의항원결합단편은 CDR이 CDR-H1 에대해서열 57, CDR-H2에대해서열 58, CDR-H3에대해서열 59 중적어도하나의펩티드로이루어진중쇄가변도메인을포함할수있다. 본발명의항체내에경쇄가존재할경우, 상기경쇄는임의의적합한상보적사슬일수있고, 특히가변도메인이 CDR-L1에대해서열 60, CDR-L2에대해서열 61 및 CDR-L3에대해서열 62에제시된서열을갖는적어도하나의 CDR을포함하는경쇄로부터선택될수있다. 항체또는이의항원결합단편은 CDR이 CDR-L1에대해서열 60, CDR-L2에대해서열 61, CDR-L3에대해서열 62 중적어도하나의펩티드로이루어진경쇄가변도메인을포함할수있다. 본발명은또한 Ab-C를비롯한단리된항체, 또는이의항원결합단편에관한것이며, 이는구체적으로스클레로스틴에결합하고, 상기중쇄의가변도메인은 CDR-H1에대해서열 45, CDR-H2에대해서열 46, CDR-H3에대해서열 47에제시된서열을갖는적어도하나의 CDR을포함한다. 항체또는이의항원결합단편은 CDR이 CDR-H1 에대해서열 45, CDR-H2에대해서열 46, CDR-H3에대해서열 47 중적어도하나의펩티드로이루어진중쇄가변도메인을포함할수있다. 본발명의항체내에경쇄가존재할경우, 상기경쇄는임의의적합한상보적사슬일수있고, 특히가변도메인이 CDR-L1에대해서열 48, CDR-L2에대해서열 49 및 CDR-L3에대해서열 50에제시된서열을갖는적어도하나의 CDR을포함하는경쇄로부터선택될수있다. 항체또는이의항원결합단편은 CDR이 CDR-L1에대해서열 48, CDR-L2에대해서열 49, CDR-L3에대해서열 50 중적어도하나의펩티드로이루어진경쇄가변도메인을포함할수있다. 본발명은또한 Ab-D를비롯한단리된항체, 또는이의항원결합단편에관한것이며, 이는구체적으로스클레로스틴에결합하고, 상기중쇄의가변도메인은 CDR-H1에대해서열 39, CDR-H2에대해서열 40, CDR-H3에대해서열 41에제시된서열을갖는적어도하나의 CDR을포함한다. 항체또는이의항원결합단편은 CDR이 CDR-H1-33 -
34 에대해서열 39, CDR-H2 에대해서열 40, CDR-H3 에대해서열 41 중적어도하나의펩티드로이루어진중쇄가 변도메인을포함할수있다. [0234] [0235] [0236] [0237] [0238] [0239] 본발명의항체내에경쇄가존재할경우, 상기경쇄는임의의적합한상보적사슬일수있고, 특히가변도메인이 CDR-L1에대해서열 42, CDR-L2에대해서열 43 및 CDR-L3에대해서열 44에제시된서열을갖는적어도하나의 CDR을포함하는경쇄로부터선택될수있다. 항체또는이의항원결합단편은 CDR이 CDR-L1에대해서열 42, CDR-L2에대해서열 43, CDR-L3에대해서열 44 중적어도하나의펩티드로이루어진경쇄가변도메인을포함할수있다. 추가의항-스클레로스틴항체를하기에기술하였다. 일부아미노산서열에대하여, 상보성-결정영역 (CDR) 은어두운네모로표시하고, 불변영역은두꺼운이탤릭체로표시하였다. Ab-2 항체 2 (Ab-2로도지칭됨 ) LC 및 HC의서열은다음과같다. Ab-2 경쇄 : Ab-2 LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 [0240] [0241] 이다. Ab-2 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 [0242] [0243] 신호펩티드를포함하는 Ab-2 LC 의아미노산서열은 이다. [0244] [0245] 신호펩티드코딩서열을포함하는 Ab-2 LC 의핵산서열은 이다. [0246] [0247] [0248] Ab-2 중쇄 Ab-2 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 이다
35 [0249] [0250] Ab-2 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 이다. [0251] [0252] 신호펩티드를포함하는 Ab-2 HC 의아미노산서열은 이다. [0253] [0254] 신호펩티드코딩서열을포함하는 Ab-2 HC 의핵산서열은 이다
36 [0255] 이다. [0256] [0257] [0258] [0259] Ab-3 항체 3 ( 본원에서 Ab-3으로도지칭됨 ) LC 및 HC의서열은다음과같다. Ab-3 경쇄 Ab-3 LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 [0260] [0261] 이다. Ab-3 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 [0262] [0263] 신호펩티드를포함하는 Ab-3 LC 의아미노산서열은 이다. [0264] [0265] 신호펩티드코딩서열을포함하는 Ab-3 LC 의핵산서열은 이다
37 [0266] 이다. [0267] [0268] Ab-3 중쇄 Ab-3 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 [0269] 이다. [0270] Ab-3 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열은 [0271] 이다. [0272] 신호펩티드를포함하는 Ab-3 HC 의아미노산서열은 [0273] 이다
38 [0274] 신호펩티드코딩서열을포함하는 Ab-3 HC 의핵산서열은 [0275] 이다. [0276] [0277] [0278] [0279] Ab-4 항체 4 ( 본원에서 Ab-4로도지칭됨 ) LC 및 HC의서열은다음과같다. Ab-4 경쇄 : Ab-4 LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0280] [0281] Ab-4 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0282] [0283] 신호펩티드를포함하는 Ab-4 LC 의아미노산서열 : [0284]
39 [0285] 신호펩티드코딩서열을포함하는 Ab-4 LC 의핵산서열 : [0286] [0287] [0288] Ab-4 중쇄 : Ab-4 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0289] [0290] Ab-4 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0291] [0292] 신호펩티드를포함하는 Ab-4 HC 의아미노산서열 : [0293]
40 [0294] 신호펩티드코딩서열을포함하는 Ab-4 HC 의핵산서열 : [0295] [0296] [0297] [0298] [0299] [0300] Ab-4를인간화하여 Ab-5를발생시켰다. Ab-5 항체 5 ( 본원에서 Ab-5로도지칭됨 ) LC 및 HC의서열은다음과같다. Ab-5 경쇄 : Ab-5 LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0301] [0302] Ab-5 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0303] [0304] 신호펩티드를포함하는 Ab-5 LC 의아미노산서열 : [0305]
41 [0306] 신호펩티드코딩서열을포함하는 Ab-5 LC 의핵산서열 : [0307] [0308] [0309] Ab-5 중쇄 : Ab-5 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0310] [0311] 카르복시 - 말단리신이없는 Ab-5 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0312]
42 [0313] Ab-5 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0314] [0315] 신호펩티드를포함하는 Ab-5 HC 의아미노산서열 : [0316] [0317] 신호펩티드코딩서열을포함하는 Ab-5 HC 의핵산서열 : [0318] [0319] Ab-5 가변도메인 :
43 [0320] Ab-5 경쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0321] [0322] Ab-5 경쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0323] [0324] Ab-5 중쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0325] [0326] Ab-5 중쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0327] [0328] Ab-5 의중쇄가변영역내 CDR ( 상보성결정영역 ) 서열은 [0329] [0330] Ab-5 의경쇄가변영역내 CDR 서열은 이다. [0331] [0332] [0333] [0334] [0335] 이다. Ab-6 항체 6 ( 본원에서 Ab-6로도지칭됨 ) LC 및 HC의서열은다음과같다. Ab-6 경쇄 : Ab-6 LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열은 [0336] 이다
44 [0337] Ab-6 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0338] [0339] 신호펩티드를포함하는 Ab-6 LC 의아미노산서열 : [0340] [0341] 신호펩티드코딩서열을포함하는 Ab-6 LC 의핵산서열 : [0342] [0343] [0344] Ab-6 중쇄 : Ab-6 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0345]
45 [0346] Ab-6 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0347] [0348] 신호펩티드를포함하는 Ab-6 HC 의아미노산서열 : [0349] [0350] 신호펩티드코딩서열을포함하는 Ab-6 HC 의핵산서열 : [0351] [0352] [0353] Ab-7 항체 7 ( 본원에서 Ab-7 로도지칭됨 ) LC 및 HC 의서열은다음과같다
46 [0354] [0355] Ab-7 경쇄 : Ab-7 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0356] [0357] Ab-7 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0358] [0359] 신호펩티드를포함하는 Ab-7 LC 의아미노산서열 : [0360] [0361] 신호펩티드코딩서열을포함하는 Ab-7 LC 의핵산서열 : [0362] [0363] [0364] Ab-7 중쇄 : Ab-7 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0365]
47 [0366] Ab-7 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0367] [0368] 신호펩티드를포함하는 Ab-7 HC 의아미노산서열 : [0369] [0370] 신호펩티드코딩서열을포함하는 Ab-7 HC 의핵산서열 : [0371] [0372] [0373] Ab-8 항체 8 ( 본원에서 Ab-8 로도지칭됨 ) LC 및 HC 의서열은다음과같다
48 [0374] [0375] Ab-8 경쇄 : Ab-8 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0376] [0377] Ab-8 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0378] [0379] 신호펩티드를포함하는 Ab-8 LC 의아미노산서열 : [0380] [0381] 신호펩티드코딩서열을포함하는 Ab-8 LC 의핵산서열 : [0382] [0383] [0384] Ab-8 중쇄 : Ab-8 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0385]
49 [0386] Ab-8 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0387] [0388] 신호펩티드를포함하는 Ab-8 HC 의아미노산서열 : [0389] [0390] 신호펩티드코딩서열을포함하는 Ab-8 HC 의핵산서열 : [0391] [0392] [0393] Ab-9 항체 9 ( 본원에서 Ab-9 로도지칭됨 ) LC 및 HC 의서열은다음과같다
50 [0394] [0395] Ab-9 경쇄 : Ab-9 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0396] [0397] Ab-9 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0398] [0399] 신호펩티드를포함하는 Ab-9 LC 의아미노산서열 : [0400] [0401] 신호펩티드코딩서열을포함하는 Ab-9 LC 의핵산서열 : [0402] [0403] [0404] Ab-9 중쇄 : Ab-9 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0405]
51 [0406] Ab-9 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0407] [0408] 신호펩티드를포함하는 Ab-9 HC 의아미노산서열 : [0409] [0410] 신호펩티드코딩서열을포함하는 Ab-9 HC 의핵산서열 : [0411] [0412] [0413] Ab-10 항체 10 ( 본원에서 Ab-10 로도지칭됨 ) LC 및 HC 의서열은다음과같다
52 [0414] [0415] Ab-10 경쇄 : Ab-10 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0416] [0417] Ab-10 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0418] [0419] 신호펩티드를포함하는 Ab-10 LC 의아미노산서열 : [0420] [0421] 신호펩티드코딩서열을포함하는 Ab-10 LC 의핵산서열 : [0422] [0423] [0424] Ab-10 중쇄 : Ab-10 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0425]
53 [0426] Ab-10 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0427] [0428] 신호펩티드를포함하는 Ab-10 HC 의아미노산서열 : [0429] [0430] 신호펩티드코딩서열을포함하는 Ab-10 HC 의핵산서열 : [0431] [0432] [0433] Ab-11 항체 11 ( 본원에서 Ab-11 로도지칭됨 ) LC 및 HC 의서열은다음과같다
54 [0434] [0435] Ab-11 경쇄 : Ab-11 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0436] [0437] Ab-11 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0438] [0439] 신호펩티드를포함하는 Ab-11 LC 의아미노산서열 : [0440] [0441] 신호펩티드코딩서열을포함하는 Ab-11 LC 의핵산서열 : [0442] [0443] [0444] Ab-11 중쇄 : Ab-11 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0445]
55 [0446] Ab-11 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0447] [0448] 신호펩티드를포함하는 Ab-11 HC 의아미노산서열 : [0449] [0450] 신호펩티드코딩서열을포함하는 Ab-11 HC 의핵산서열 : [0451] [0452] [0453] [0454] Ab-12 항체 12 ( 본원에서 Ab-12 로도지칭됨 ) LC 및 HC 의서열은다음과같다. Ab-12 경쇄 :
56 [0455] Ab-12 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0456] [0457] Ab-12 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0458] [0459] 신호펩티드를포함하는 Ab-12 LC 의아미노산서열 : [0460] [0461] 신호펩티드코딩서열을포함하는 Ab-12 LC 의핵산서열 : [0462] [0463] [0464] Ab-12 중쇄 : Ab-12 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0465]
57 [0466] Ab-12 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0467] [0468] 신호펩티드를포함하는 Ab-12 HC 의아미노산서열 : [0469] [0470] 신호펩티드코딩서열을포함하는 Ab-12 HC 의핵산서열 : [0471] [0472] [0473] Ab-13 항체 13 ( 본원에서 Ab-13 으로도지칭됨 ) LC 및 HC 의서열은다음과같다
58 [0474] [0475] Ab-13 경쇄 : Ab-13 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0476] [0477] Ab-13 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0478] [0479] 신호펩티드를포함하는 Ab-13 LC 의아미노산서열 : [0480] [0481] 신호펩티드코딩서열을포함하는 Ab-13 LC 의핵산서열 : [0482] [0483] [0484] Ab-13 중쇄 : Ab-13 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0485]
59 [0486] Ab-13 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0487] [0488] 신호펩티드를포함하는 Ab-13 HC 의아미노산서열 : [0489] [0490] 신호펩티드코딩서열을포함하는 Ab-13 HC 의핵산서열 : [0491] [0492] [0493] Ab-13 을인간화하여 Ab-14 를발생시켰다. 항체 14 ( 본원에서 Ab-14 로도지칭됨 ) LC 및 HC 의서열은다음과 같다. Ab-14 경쇄
60 [0494] Ab-14 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0495] [0496] Ab-14 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0497] [0498] 신호펩티드를포함하는 Ab-14 LC 의아미노산서열 : [0499] [0500] 신호펩티드코딩서열을포함하는 Ab-14 LC 의핵산서열 : [0501] [0502] [0503] Ab-14 중쇄 : Ab-14 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0504] [0505] 카르복시 - 말단리신이없는 Ab-14 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0506]
61 [0507] Ab-14 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0508] [0509] 신호펩티드를포함하는 Ab-14 HC 의아미노산서열 : [0510] [0511] 신호펩티드코딩서열을포함하는 Ab-14 HC 의핵산서열 : [0512] [0513] Ab-14 의중쇄가변영역내 CDR 서열은
62 [0514] 이다. [0515] Ab-14 의경쇄가변영역내 CDR 서열은 [0516] [0517] [0518] Ab-14 가변도메인 : 이다. Ab-14 경쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0519] [0520] Ab-14 경쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0521] [0522] Ab-14 중쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0523] [0524] Ab-14 중쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0525] [0526] [0527] [0528] [0529] [0530] Ab-3을인간화하여 Ab-15를발생시켰다. Ab-15 항체 15 ( 본원에서 Ab-15로도지칭됨 ) LC 및 HC의서열은다음과같다. Ab-15 경쇄 : Ab-15 LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0531]
63 [0532] Ab-15 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0533] [0534] 신호펩티드를포함하는 Ab-15 LC 의아미노산서열 : [0535] [0536] 신호펩티드코딩서열을포함하는 Ab-15 LC 의핵산서열 : [0537] [0538] [0539] Ab-15 중쇄 Ab-15 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0540] [0541] 카르복시 - 말단리신이없는 Ab-15 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0542]
64 [0543] Ab-15 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0544] [0545] 신호펩티드를포함하는 Ab-15 HC 의아미노산서열 : [0546] [0547] 신호펩티드코딩서열을포함하는 Ab-15 HC 의핵산서열 : [0548] [0549] Ab-15 의중쇄가변영역내 CDR 서열은
65 [0550] 이다. [0551] Ab-15 의경쇄가변영역내 CDR 서열은 [0552] [0553] [0554] Ab-15 가변도메인 : 이다. Ab-15 경쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0555] [0556] Ab-15 경쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0557] [0558] Ab-15 중쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0559] [0560] Ab-15 중쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0561] [0562] [0563] [0564] [0565] [0566] Ab-11을인간화하여 Ab-16을발생시켰다. Ab-16 항체 16 ( 본원에서 Ab-16로도지칭됨 ) LC 및 HC의서열은다음과같다. Ab-16 경쇄 : Ab-16 LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0567]
66 [0568] Ab-16 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0569] [0570] 신호펩티드를포함하는 Ab-16 LC 의아미노산서열 : [0571] [0572] 신호펩티드코딩서열을포함하는 Ab-16 LC 의핵산서열 : [0573] [0574] [0575] Ab-16 중쇄 : Ab-16 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0576] [0577] 카르복시 - 말단리신이없는 Ab-16 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0578]
67 [0579] Ab-16 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0580] [0581] 신호펩티드를포함하는 Ab-16 HC 의아미노산서열 : [0582] [0583] 신호펩티드코딩서열을포함하는 Ab-16 HC 의핵산서열 : [0584] [0585] Ab-16 의중쇄가변영역내 CDR 서열은
68 [0586] 이다. [0587] Ab-16 의경쇄가변영역내 CDR 서열은 [0588] [0589] [0590] Ab-16 가변도메인 : 이다. Ab-16 경쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0591] [0592] Ab-16 경쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0593] [0594] Ab-16 중쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0595] [0596] Ab-16 중쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0597] [0598] 추가항체는본원에서항체 ( 본원에서 Ab-17, Ab-18, Ab-19, Ab-20, Ab-21 및 Ab-22 로도지칭됨 ) 로지칭 된다. Ab-17, Ab-19 및 Ab-21 의모든 VK 영역에대한 κ 불변영역은다음과같다. [0599] [0600] 항체 17, 19 및 21 의 VH 영역에대한중쇄불변영역은다음과같다. [0601] [0602] [0603] 다음의항체아미노산서열에서, 어두운 - 네모로표시한아미노산은상보성 - 결정영역 (CDR) 을나타내고, 밑줄친 아미노산은신호펩티드를나타낸다. Ab
69 [0604] 신호펩티드를포함하는 Ab-17 LC 의아미노산서열 : [0605] [0606] 신호펩티드를포함하는 Ab-17 LC 의핵산서열 : [0607] [0608] 신호펩티드를포함하는 Ab-17 HC 의아미노산서열 : [0609] [0610] 신호펩티드를포함하는 Ab-17 HC 의핵산서열 : [0611] [0612] [0613] [0614] Ab-17 을인간화하여 Ab-18 을발생시켰다. Ab-18 신호펩티드를포함하는 Ab-18 LC 의아미노산서열 : [0615] [0616] 신호펩티드를포함하는 Ab-18 LC 의핵산서열 : [0617] [0618] 신호펩티드를포함하는 Ab-18 HC 의아미노산서열 : [0619] [0620] 신호펩티드를포함하는 Ab-18 HC 의핵산서열 : [0621]
70 [0622] Ab-18 경쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0623] [0624] Ab-18 경쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0625] [0626] Ab-18 중쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0627] [0628] Ab-18 중쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0629] [0630] [0631] Ab-19 신호펩티드를포함하는 Ab-19 LC 의아미노산서열 : [0632] [0633] 신호펩티드를포함하는 Ab-19 LC 의핵산서열 : [0634] [0635] 신호펩티드를포함하는 Ab-19 HC 의아미노산서열 : [0636] [0637] 신호펩티드를포함하는 Ab-19 HC 의핵산서열 : [0638] [0639] [0640] Ab-19 을인간화하여항체 20 ( 본원에서 Ab-20 로도지칭됨 ) 및항체 23 ( 본원에서 Ab-23 으로도지칭됨 ) 을발생시 켰다. Ab
71 [0641] [0642] IgG4 버젼 신호펩티드를포함하는 Ab-20 LC 의아미노산서열 : [0643] [0644] 신호펩티드를포함하는 Ab-20 LC 의핵산서열 : [0645] [0646] 신호펩티드를포함하는 Ab-20 HC 의아미노산서열 : [0647] [0648] 신호펩티드를포함하는 Ab-20 HC 의핵산서열 : [0649] [0650] [0651] [0652] [0653] Ab-23 IgG2 버젼경쇄 : Ab-23 LC의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0654] [0655] Ab-23 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0656] [0657] 신호펩티드를포함하는 Ab-23 LC 의아미노산서열 : [0658]
72 [0659] 신호펩티드코딩서열을포함하는 Ab-23 LC 의핵산서열 : [0660] [0661] [0662] 중쇄 : Ab-23 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0663] [0664] 카르복시 - 말단리신이없는 Ab-23 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0665] [0666] Ab-23 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0667]
73 [0668] 신호펩티드를포함하는 Ab-23 HC 의아미노산서열 : [0669] [0670] 신호펩티드코딩서열을포함하는 Ab-23 HC 의핵산서열 : [0671] [0672] Ab-23 의중쇄가변영역내 CDR ( 상보성결정영역 ) 서열은 [0673] [0674] Ab-23 의경쇄가변영역내 CDR 서열은 이다. [0675] [0676] [0677] Ab-23 가변도메인 : 이다. Ab-23 경쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0678] [0679] Ab-23 경쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0680]
74 [0681] Ab-23 중쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0682] [0683] Ab-23 중쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0684] [0685] [0686] Ab-21 신호펩티드를포함하는 Ab-21 LC 의아미노산서열 : [0687] [0688] 신호펩티드를포함하는 Ab-21 LC 의핵산서열 : [0689] [0690] 신호펩티드를포함하는 Ab-21 HC 의아미노산서열 : [0691] [0692] 신호펩티드를포함하는 Ab-21 HC 의핵산서열 : [0693] [0694] [0695] [0696] Ab-21 을인간화하여 Ab-22 를수득하였다. Ab-22 신호펩티드를포함하는 Ab-22 LC 의아미노산서열 : [0697] [0698] 신호펩티드를포함하는 Ab-22 LC 의핵산서열 : [0699]
75 [0700] 신호펩티드를포함하는 Ab-22 HC 의아미노산서열 : [0701] [0702] 신호펩티드를포함하는 Ab-22 HC 의핵산서열 : [0703] [0704] Ab-22 경쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0705] [0706] Ab-22 경쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0707] [0708] Ab-22 중쇄가변도메인의아미노산서열 ( 신호서열부재 ): [0709] [0710] Ab-22 중쇄가변도메인의 DNA 서열 ( 신호서열부재 ): [0711] [0712] Ab-18, Ab-20 및 Ab-22 에대하여, 경쇄인간 κ 불변영역은다음과같다. [0713] [0714] 중쇄인간 λ-4 불변영역은다음과같다. [0715] [0716] [0717] [0718] [0719] 힌지 (hinge) 영역은 Ser-241-Pro 돌연변이를함유하여힌지안정성을증진시킨다 ( 문헌 [Angal S et al, (1993), Mol Immunol, 30(1), ]) Ab-24 항체 24 ( 본원에서 Ab-24로도지칭됨 ) LC 및 HC의영역은다음과같다. 경쇄 :
76 [0720] Ab-24 LC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0721] [0722] Ab-24 LC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0723] [0724] 신호펩티드를포함하는 Ab-24 LC 의아미노산서열 : [0725] [0726] 신호펩티드코딩서열을포함하는 Ab-24 LC 의핵산서열 : [0727] [0728] [0729] Ab-24 중쇄 : Ab-24 HC 의성숙한형태 ( 신호펩티드제거 ) 의아미노산서열 : [0730]
77 [0731] Ab-24 HC 의성숙한형태 ( 신호펩티드제거 ) 를코딩하는핵산서열 : [0732] [0733] 신호펩티드를포함하는 Ab-24 HC 의아미노산서열 : [0734] [0735] 신호펩티드코딩서열을포함하는 Ab-24 HC 의핵산서열 : [0736] [0737] Ab-24 의경쇄가변영역내 CDR 서열은
78 [0738] [0739] Ab-24 의중쇄가변영역내 CDR 서열은 이다. [0740] [0741] [0742] 이다. 하기표 1은 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab-10, Ab- 1l, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24의 CDR 서열및아미노산서열을제공한다. 카바트 (Kabat) 번호화시스템 ( 문헌 [Kabat et al, 1987 in 서열 of Proteins of Immunological Interest, U.S. Department of Health and Human Services, NIH, USA]) 에따라, L1, L2 및 L3은경쇄 CDR의 1, 2 및 3을나타내고, H1, H2 및 H3은중쇄 CDR의 1, 2 및 3을나타낸다. < 표 1A> [0743]
79 [0744] < 표 1B> [0745] [0746] < 표 1C> [0747]
80 [0748] [0749] [0750] [0751] [0752] [0753] 올리고펩티드또는폴리펩티드가상기표 1 중 1개이상의 CDR 및 / 또는항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab- 17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중하나이상이스클레로스틴과결합하는것을교차- 차단하는스클레로스틴결합제의 CDR과 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 이상동일한아미노산서열을갖고 / 거나, 항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab- 9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중하나이상이스클레로스틴과결합하는것 ; 및 / 또는세포기재미네랄화검정 ( 즉, 스클레로스틴중화결합제 ) 에서스클레로스틴의억제효과를차단할수있는스클레로스틴결합제의 CDR에결합하는것 ; 및 / 또는루프 2 에피토프에결합하는스클레로스틴결합제의 CDR에결합하는것 ; 및 / 또는 T20.6 에피토프에결합하는스클레로스틴결합제의 CDR에결합하는것 ; 및 / 또는 "T20.6 유도체 ( 시스틴-노트 +4 아암 )" 에피토프에결합하는스클레로스틴결합제의 CDR에결합하는것을교차-차단할경우, 상기올리고펩티드또는폴리펩티드는본발명의범주내에있다. 스클레로스틴결합제폴리펩티드및항체가항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab- 6, Ab-7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab- 21, Ab-22, Ab-23 및 Ab-24 중하나이상의가변영역과 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93 %, 94%, 95%, 96%, 97%, 98% 또는 99% 이상동일한아미노산서열을갖고, 항체 Ab-A, Ab-B, Ab-C, Ab- D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab- 16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중하나이상이스클레로스틴과결합하는것을교차-차단하고 / 거나, 항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab- 9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중하나이상이스클레로스틴에결합하는것이교차-차단되고 / 거나 ; 세포기재미네랄화검정 ( 즉, 스클레로스틴중화결합제 ) 에서스클레로스틴의억제효과를차단할수있고 / 거나 ; 루프 2 에피토프에결합하고 / 거나 ; T20.6 에피토프에결합하고 / 거나 ; "T20.6 유도체 ( 시스틴-노트 +4 아암 )" 에피토프에결합할경우, 상기스클레로스틴결합제폴리펩티드및항체는본발명의범주내에있다. 스클레로스틴결합제를코딩하는폴리뉴클레오티드가항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중하나이상의가변영역을코딩하는폴리뉴클레오티드와 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 또는 99% 이상동일한아미노산서열을갖고, 여기서코딩된스클레로스틴결합제가항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab-13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중하나이상이스클레로스틴과결합하는것을교차-차단하고 / 거나, 항체 Ab-A, Ab-B, Ab-C, Ab-D, Ab-1, Ab-2, Ab-3, Ab-4, Ab-5, Ab-6, Ab-7, Ab-8, Ab-9, Ab-10, Ab-11, Ab-12, Ab- 13, Ab-14, Ab-15, Ab-16, Ab-17, Ab-18, Ab-19, Ab-20, Ab-21, Ab-22, Ab-23 및 Ab-24 중하나이상이스클레로스틴에결합하는것이교차-차단되고 / 거나 ; 세포기재미네랄화검정 ( 즉, 스클레로스틴중화결합제 ) 에서스클레로스틴의억제효과를차단할수있고 / 거나 ; 루프 2 에피토프에결합하고 / 거나 ; T20.6 에피토프에결합하고 / 거나 ; "T20.6 유도체 ( 시스틴-노트 +4 아암 )" 에피토프에결합할경우, 상기스클레로스틴결합제를코딩하는폴리뉴클레오티드는본발명의범주내에있다. 본발명에따른항체는인간스클레로스틴에대해 1 x 10-7M 이하, 1 x 10-8M 이하, 1 x 10-9M 이하, 1 x 10-10M 이하, 1 x 10-11M 이하또는 1 x 10-12M 이하의결합친화도를가질수있다. 결합제, 예컨대항체또는결합파트너의친화도, 및결합제 ( 예컨대, 항체 ) 가결합을억제하는정도는당업자가통상의기술, 예를들어문헌 [Scatchard et al., Ann. KY. Acad. Sci. 51: (1949)] 에기술된것또는표면플라스몬공명을이용하여결정할수있다. 표면플라스몬공명에있어서, 표적분자는고체상에고정되고유동세포를따라흐르는이동상에서리간드에노출된다. 고정된표적에결합한리간드가발생할경우, 국소적반사인덱스가변화되어 SPR 각의변화를초래하고, 이는반사된빛의강도변화를검출함으로써실시간으로모니터링될수있다. SPR 신호의변화율을분석하여결합반응의연합상및해리상에대한명확한속도상수를얻을수있다. 이들값의비율은명확한평형상수 ( 친화도 ) 이다 ( 예를들어, 문헌 [Wolff et al, Cancer Res. 53: (1993)] 참조 ). 본발명에따른항체는임의의이뮤노글로불린부류, 예를들어 IgG, IgE, IgM, IgD 또는 IgA에속할수있다
81 이는동물, 예를들어, 조류 ( 예를들어, 닭 ) 및포유동물 ( 마우스, 래트, 햄스터, 토끼또는다른설치류, 소, 말, 양, 염소, 카멜, 인간또는다른영장류가포함되나, 이에제한되지않음 ) 로부터수득하거나유래될수있다. 상기항체는내면화된항체일수있다. 항체의제조는일반적으로미국특허공개번호제2004/ A1 호에개시되어있다. [0754] [0755] [0756] [0757] [0758] [0759] [0760] [0761] [0762] 특성화검정특정 Ab-A, Ab-B, Ab-C, Ab-D 및항체 1-24 (Ab-1 내지 Ab-24) CDR을신규골격및 / 또는불변영역내로조작하는것을포함하는본발명에따른항체를발생시키기위한상기기술한방법에서, 목적하는항체또는결합제를선택하기위한적절한검정 ( 즉, 스클레로스틴에대한결합친화도를측정하기위한검정 ; 교차-차단검정 ; 비아코어-기재 " 인간스클레로스틴펩티드에피토프경쟁적결합검정 "; MC3T3-E1 세포기재검정 ; 생체내검정 ) 을이용할수있다. 에피토프결합검정성숙한형태의인간스클레로스틴은시스틴-노트구조를갖는 190개의아미노산당단백질이다 ( 도 8 및 9). 시스틴-노트구조에추가로, 상기단백질은 3개의루프 ( 루프 1, 루프 2 및루프 3으로고안됨 ) 를갖는것을특징으로한다. 인간스클레로스틴을단백질분해에적용시켜단편을제조한다. 요약하면, 트립신, aspn 및 lysc 를비롯한상이한프로테아제를사용하여, 다양한절단부위및크기를갖는단편을발생시킨다. 다양한인간스클레로스틴펩티드의서열및중량을측정한다. 항체보호정도를측정하여클리핑부위차폐및펩티드이동을비롯한, 단백질분해에대한접근성의효과를결정한다. 마지막으로, 비아코어-기재 " 인간스클레로스틴펩티드에피토프경쟁검정 " 을수행한다. 스클레로스틴을트립신절단에노출시켜도 13에요약된바와같은펩티드단편패턴을생성시킨다. 상기단편을 T19.2, T20, T20.6 및 T21-22로지칭한다. 도 19B에도식화한바와같이, T20.6 에피토프는시스틴-노트영역의 3개의디술피드결합에의해결합된 4개의분리펩티드서열의복합체이다. 상기펩티드중 2개는 2개의디술피드결합에의해결합된다. 다른두개의펩티드는도식적으로처음두개의폴리펩티드를양분하는하나이상의디술피드결합에의해연결된다. 트립신소화에의해발생된 T20.6 에피토프는천연폴리펩티드의시스틴-노트구조를보유하고, 항체 Ab-C 및 Ab-D에의해인지된다. 에피토프 T20.6의유도체는서열 1로지칭된서열위치에서시스틴-노트영역및아미노산 58-64, 73-81, 및 로이루어져있다. 이러한유도체에피토프를도 21에나타내었다. 시스틴-노트영역을포함하는에피토프는 T20.6 에피토프 ( 도 19B) 내에존재하나 T20.6 유도체에피토프 ( 도 21) 에는존재하지않는하나이상의아미노산을가질수있다. 다른에피토프-함유영역은인간스클레로스틴의루프 2 영역 ( 도 19A) 내에서확인되고, 항체 Ab-A 및 Ab-B에의해인지된다. 루프 2 에피토프는서열 1의아미노산 (C4GPARLLPNAIGRGKWWRPSGPDFRC5, 서열 6) 을포함한다. 입체적으로서열 1의전장스클레로스틴에대하여, 루프 2-함유구조는한쪽말단에서위치 86 (C4) 의시스테인과위치 144 (C8) 의시스테인사이의디술피드결합, 및다른쪽말단에서위치 111 (C5) 의시스테인과위치 57 (C1) 의시스테인사이의디술피드결합으로정의된다. 인간스클레로스틴의 aspn 절단에의해발생된펩티드를도 12에나타내었다. 상기도면에서, 이들펩티드를 AspN14.6, AspN18.6 및 AspN 로지정하고, 본원에서는각각 N14.6, N18.6 및 N 로도지칭한다. 일군의항체는비아코어-기재 " 인간스클레로스틴펩티드에피토프경쟁적결합검정 " 으로입증되는, 특정에피토프에결합하는구체적인패턴을보인다. 요약하면, 항체상의에피토프-결합부위를포화시킬농도에서, 상기항체를시험할에피토프와함께예비인큐베이션한다. 이어서, 상기항체를칩표면에결합된스클레로스틴에노출시킨다. 적절한인큐베이션및세척절차후에, 경쟁적결합패턴이성립된다. 도 18에나타낸바와같이, 스클레로스틴분자에결합된예시적항체 Ab-D를칩의표면에부착시켰다. 항체 Ab-D를스클레로스틴과함께예비인큐베이션하자, 칩상의스클레로스틴에결합한항체는감소하여 0에가까워졌다. 에피토프 T19.2로이루어진펩티드와함께예비인큐베이션하자, T19.2는항체결합에대해스클레로스틴과경쟁하지않았다. 그러나, T20, T20.6, T21-22 또는 N 로지정한에피토프중어느하나와함께예비인큐베이션하자, 상기칩상의스클레로스틴과항체와의결합중많은부분이파괴되었다. 반대로, 상기항체를 T19.2, N14.6 또는 N18.6으로지정된에피토프중어느하나와함께예비인큐베이션하자스클레로스틴에결합하는항체의능력이파괴되지않았다. 이러한결합프로파일 ( 도 17) 을갖는두번째예시적항체는 Ab-C이다
82 [0763] [0764] [0765] [0766] [0767] [0768] 그러므로, 항체 Ab-D는예시이고, 에피토프 T20, T20.6, T21-22 및 N 에결합하는대표적인일군의항체이며, 스클레로스틴에결합하는항체를차단하는능력으로측정시에피토프 T19.2, N14.6 및 N18.6에최소한으로검출가능하게결합한다. 이러한결합패턴특성을갖는항체는항체분자중하나이상의영역에서아미노산서열을공유할수있거나, 또는그렇지않다. 항체유사도는기능적으로, 예컨대상기기술한각각의에피토프와함께예비인큐베이션한후에스클레로스틴에결합하는능력으로측정한다. 항체 Ab-D의결합패턴과유사하거나동일한패턴을보이는항체가본발명에포함된다. "~ 와유사한 " 은, 예를들어항체가각각의폴리펩티드 T20, T20.6, T21-22 및 N 에결합함으로써, 이러한결합이구체적으로, 달리스클레로스틴또는스클레로스틴펩티드와함께예비인큐베이션하지않고발생하는, 스클레로스틴에결합하는항체의 50% 이상과경쟁하는것을의미한다. 상기항체는또한폴리펩티드 T19.2, N14.6 및 N18.6에거의결합하지않거나또는검출가능한정도로결합해서, 스클레로스틴또는스클레로스틴펩티드와함께예비인큐베이션하지않고발생하는결합이 30% 이하로감소하도록한다. 예를들어, 특정기전에얽매이지않고, 도 18의항체결합패턴은항체 Ab-D, 및 Ab-D 결합의에피토프결합패턴을갖는다른항체가결합하는에피토프공간이스클레로스틴의시스틴-노트영역을포함하는폴리펩티드로이루어졌음을시사한다. 따라서, 본원에개시되고도 19B에언급한바와같이, 예시적인 T20.6 에피토프는이들분리디술피드결합을통해부착된 4개의펩티드사슬을포함한다. 펩티드사슬인 SAKPVTELVC3SGQC4GPAR ( 서열 3) 은디술피드결합에의해 C3에서 C7로및 C4에서 C8로펩티드사슬 LVASC7KC8KRLTR ( 서열 5) 에부착된다. 펩티드사슬인 DVSEYSC1RELHFTR ( 서열 2) 은디술피드결합에의해 C1에서 C5로펩티드사슬 WWRPSGPDFRC5IPDRYR ( 서열 4) 에부착된다. 서열 3 및 5의폴리펩티드는입체적구축을통해서열 2 및 4의폴리펩티드와연결된채로남아있고, 이로써도 19B에도시한바와같이 C1-C5 결합은 C4-C8 및 C3-C7 결합판을교차하고, 이들사이에위치한다. 본원에개시된바와같이, 예시적인 T20.6 유도체에피토프는 3개의개별적인디술피드결합을통해부착된 4개의펩티드쇄를포함한다 ( 도 21 참조 ). 펩티드쇄 SAKPVTELVC3SGQC4 ( 서열 70) 는디술피드결합 (C3-C7 결합및 C4-C8 결합 ) 에의해펩티드쇄 LVASC7KC8 ( 서열 71) 에부착된다. 펩티드쇄 C1RELHFTR ( 서열 72) 은디술피드결합 (C1-C5 결합 ) 에의해펩티드쇄 C5IPDRYR ( 서열 73) 에부착된다. 서열 70 및 71의폴리펩티드들은입체구조물 ( 도 21에예시된바와같이, C1-C5 결합은 C4-C8 결합및 C3-C7 결합으로이루어진면을가로질러그사이에위치함 ) 을통해서열 72 및 73의폴리펩티드들과의결합을유지한다. 항체 Ab-A는예시적인항체이며, 항체 Ab-C 및 Ab-D의경우에서얻어진것과구별되는, 인간스클레로스틴펩티드로의특징적인결합패턴을갖는또다른항체군을대표하는항체이다. Ab-A 및 Ab-A가대표하는항체군은 N 에피토프에결합하고, 에피토프 T19.2, T20, T20.6, T21-22, N14.6 또는 N18.6과는, 스클레로스틴으로의항체결합을차단하는능력의측정시에최소한으로검출가능한결합을형성한다 ( 도 15). 이러한결합프로파일을갖는또다른예시적인항체는 Ab-B이다 ( 도 16). 이러한특징적인결합패턴을갖는항체들은항체분자의하나이상의영역에서아미노산서열을공유할수있다. 항체유사성은상기기재된각에피토프와의사전인큐베이션후에스클레로스틴결합능력에따라기능적으로결정된다. 본발명은, 항체 Ab-A의결합패턴과유사하거나동일한결합패턴을나타내는항체들을포함한다. " 유사 " 란, 예를들어항체가 N 폴리펩티드에결합하고, 이때이결합이, 스클레로스틴또는스클레로스틴펩티드와의사전인큐베이션이없이달리생성되는항체와스클레로스틴의결합에비해 50% 이상특이적으로우세한경우를의미한다. 또한, 상기항체는폴리펩티드 T19.2, T20, T20.6, T21-22, N14.6 및 N18.6으로의검출가능한결합을거의또는전혀나타내지않고, 이에따라스클레로스틴또는스클레로스틴펩티드와의사전인큐베이션이없이달리생성되는결합에비해 30% 이하감소된수준을나타낸다. 예를들어, 특정메카니즘에속박됨이없이, 도 15의항체결합패턴은, 항체 Ab-A 및 Ab-A의에피토프결합패턴을갖는여타항체가결합하는에피토프공간이스클레로스틴의루프 2 영역을포함하는폴리펩티드로구성되어있음을시사한다. 따라서, 본원에개시된바와같이, 루프 2 영역은선형펩티드로기술될수있으나, 천연디술피드결합구조가유지된스클레로스틴의시스테인-매듭-함유부분또는천연스클레로스틴내에존재하는경우에는 3차구조를획득한다 ( 도 19A 참조 ). 하기실시예에서논의된바와같이, 루프 2 에피토프의선형또는 3차구조는항체로의결합에영향을미칠수있다. 루프 2 영역은아미노산서열 C4GPARLLPNAIGRGKWWRPSGPDFRC5 ( 서열 6) 를포함할수있다. "C4" 는서열 1을기준으로 86-위치에위치한시스테인잔기를의미한다. "C5" 는서열 1을기준으로 111-위치에위치한시스테인잔기를의미한다. 천연스클레로스틴단백질에서, C4는디술피드결합에의해 144-위치의시스테인 (C8) 으로연결되고, C5는디술피드결합에
83 의해 57-위치의시스테인 (C1) 으로연결된다. 루프 2 영역으로부터유래된에피토프에는 CGPARLLPNAIGRGKWWRPS ( 서열 63); GPARLLPNAIGRGKWWRPSG ( 서열 64); PARLLPNAIGRGKWWRPSGP ( 서열 65); ARLLPNAIGRGKWWRPSGPD ( 서열 66); RLLPNAIGRGKWWRPSGPDF ( 서열 67); LLPNAIGRGKWWRPSGPDFR ( 서열 68); 및 LPNAIGRGKWWRPSGPDFRC ( 서열 6 9) 가포함된다. [0769] [0770] [0771] [0772] [0773] [0774] [0775] [0776] [0777] [0778] [0779] [0780] [0781] [0782] [0783] 교차-차단검정본원에서사용된 " 교차-차단 " 이란용어는, 소정의항체또는다른결합제가그밖의항체또는결합제와스클레로스틴의결합을방해할수있음을의미한다. 경쟁결합검정법을이용하여, 소정의항체또는다른결합제가또다른항체또는결합제와스클레로스틴의결합을방해하는정도, 나아가본발명에따른교차-차단을하는것으로판단될수있는지여부를측정할수있다. 특히적합한한정량적검정법에서는, 표면플라즈몬공명기술을이용하여상호작용의정도를측정할수있는비아코어기기가이용된다. 적합한또다른정량적교차-차단검정법에서는, 항체또는다른결합제가스클레로스틴에결합할때이들간의경쟁수준을측정하는 ELISA-기반방법이이용된다. 비아코어교차-차단검정항체또는다른결합제가본발명에따른교차-차단을하는지또는교차-차단을할수있는지여부를결정하는데적합한비아코어검정이개괄적으로하기기재되어있다. 편의상, 2종의항체가언급되나, 본원에기재된모든스클레로스틴결합제에대한검정이수행될있음을알것이다. 비아코어기기 ( 예를들어, 비아코어 3000) 는제조사의추천에따라작동시킨다. 따라서, 한교차-차단검정에서는, 표준아민커플링화학을이용하여스클레로스틴을 CM5 비아코어칩에커플링시킴으로써스클레로스틴-코팅표면을생성한다. 통상적으로, 200 내지 800개의스클레로스틴공명단위가칩에결합될것이다 ( 쉽게측정가능한수준의결합이얻어지지만, 사용되는시험시약의농도에따라쉽게포화될수있는양임 ). 서로교차-차단하는능력을평가할 2종의항체 (A* 및 B* 로지칭됨 ) 를적합한완충액중에서 1:1의결합부위몰비로혼합하여시험혼합물을생성한다. 결합부위를기준으로한농도계산시, 항체의분자량은항체의총분자량을항체상의스클레로스틴결합부위의개수로나눈값으로가정한다. 시험혼합물중각항체의농도는비아코어칩에포획된스클레로스틴분자상에존재하는항체결합부위들을쉽게포화시키기에매우충분해야한다. 혼합물중항체들의몰농도 ( 결합부위기준 ) 는서로동일하며, 그농도는통상적으로 1.00 내지 1.5 μm ( 결합부위기준 ) 이다. 또한, 항체 A* 및항체 B* 를각각단독으로함유하는개별용액을제조한다. 상기항체 A* 용액및항체 B* 용액은완충액및농도가시험혼합물과동일해야한다. 시험혼합물을스클레로스틴-코팅비아코어칩위로통과시키고, 총결합수준을기록한다. 이후, 칩에결합된스클레로스틴을손상시키지않으면서결합된항체가분리되도록칩을처리한다. 통상적으로, 상기처리는칩을 60초간 30 mm HCl로처리함으로써수행된다. 이후, 항체 A* 단독의용액을스클레로스틴-코팅표면위로통과시키고, 결합수준을기록한다. 또다시, 칩에결합된스클레로스틴을손상시키지않으면서결합된모든항체가분리되도록칩을처리한다. 이후, 항체 B* 단독의용액을스클레로스틴-코팅표면위로통과시키고, 결합수준을기록한다. 그다음, 항체 A* 과항체 B* 의혼합물의최대이론적결합수준을계산하되, 이수준은각항체를스클레로스틴표면위로단독으로통과시켰을때각각의결합수준들의합이다. 실제기록된혼합물의결합수준이상기이론적최대수준보다낮은경우, 두항체는서로교차-차단을한것이다. 따라서, 일반적으로, 상기비아코어교차-차단검정법에있어서, 본발명에따른교차-차단성항체또는다른결합제는검정동안, 그리고본발명의제2 항체또는다른결합제의존재하에기록된결합수준이두항체또는결합제들의조합의최대이론적결합수준 ( 상기정의된바와같음 ) 의 80% 내지 0.1% ( 예를들어, 80% 내지 4%), 구체적으로는 75% 내지 0.1% ( 예를들어, 75% 내지 4%), 보다구체적으로는 70% 내지 0.1% ( 예를들어, 70% 내지 4%) 가되도록스클레로스틴에결합한다. 상기기재된비아코어검정법은항체들또는다른결합제들이서로본발명에따른교차-차단을하는지여부를
84 결정하기위해이용되는주요검정법이다. 드문경우지만, 특정항체또는다른결합제는아민화학을통해 CM5 비아코어칩에커플링된스클레로스틴에결합하지않을수도있다 ( 일반적으로, 이러한경우는스클레로스틴상의해당결합부위가칩으로의커플링에의해차폐되거나파괴된경우에발생함 ). 이러한경우, 태그가부착된형태의스클레로스틴, 예를들어 His-태그가부착된 N-말단스클레로스틴 ( 미국미네소타주미니애폴리스에소재한알앤디시스템즈 (R&D Systems); 2005 cat# 1406-ST-025) 을이용하여교차-차단을측정할수있다. 이러한특정방식에서는, 항-His 항체가비아코어칩에커플링된후에 His-태그가부착된스클레로스틴이칩의표면위로통과하여항-His 항체에의해포획된다. 각칩의재생사이클후에새로운 His-태그가부착된스클레로스틴이항-His 항체-코팅표면상에다시로딩되는것을제외하고는, 상기교차-차단검정은본질적으로상기기재된바와같이수행된다. His-태그가부착된 N-말단스클레로스틴을사용하는주어진예이외에도, His-태그가부착된 C-말단스클레로스틴이대체적으로사용될수있다. 또한, 이러한교차-차단검정에서는당업계에알려져있는여타각종태그및태그결합단백질조합이이용될수있다 ( 예를들어, 항-HA 항체를갖는 HA 태그 ; 항-FLAG 항체를갖는 FLAG 태그 ; 스트렙타비딘을갖는비오틴태그 ). [0784] [0785] [0786] [0787] [0788] [0789] [0790] [0791] [0792] ELISA-기반교차-차단검정항-스클레로스틴항체또는다른스클레로스틴결합제가본발명에따른교차-차단을하는지또는교차-차단을할수있는지여부를결정하기위한 ELISA 검정법이개괄적으로하기기재된다. 편의상, 2종의항체 (Ab-X 및 Ab-Y) 가언급되나, 본원에기재된모든스클레로스틴결합제에대한검정이수행될있음을알것이다. 상기검정의일반원리는 ELISA 플레이트의웰상에코팅된항-스클레로스틴항체에있다. 과잉량의잠재적교차-차단성제2 항-스클레로스틴항체를용액상태로첨가한다 ( 즉, ELISA 플레이트에결합되지않음 ). 이후, 제한된양의스클레로스틴을웰에첨가한다. 코팅된항체및용액중의항체는제한된수의스클레로스틴분자로의결합을위해경쟁한다. 코팅된항체에결합하지않은스클레로스틴을제거하면서액상의제2 항체, 및액상의제2 항체와스클레로스틴사이에서형성된모든복합체를제거하기위해플레이트를세척한다. 이후, 적절한스클레로스틴검출시약을사용하여결합된스클레로스틴의양을측정한다. 코팅된항체를교차-차단할수있는액상의항체가사용되는경우, 코팅된항체가결합할수있는스클레로스틴분자의수는코팅된항체가액상의제2 항체의부재하에결합할수있는스클레로스틴분자의수에비해감소될수있다. 상기검정은 Ab-X 및 Ab-Y와관련하여아래에서보다상세하게기술된다. Ab-X로서고정화항체가선택된경우, Ab-X를 ELISA 플레이트의웰상에코팅한후, 후속적으로첨가되는시약의비-특이적결합을최소화하기위해플레이트를적합한차단용액으로차단한다. 이후, 웰당 Ab-Y 스클레로스틴결합부위의몰수가, 웰당 ELISA 플레이트의코팅동안사용된 Ab-X 스클레로스틴결합부위의몰수보다 10배이상높도록과잉량의 Ab- Y를 ELISA 플레이트에첨가한다. 이후, 웰당첨가된스클레로스틴의몰수가, 각웰의코팅을위해사용된 Ab- X 스클레로스틴결합부위의몰수보다 25배이상낮도록스클레로스틴을첨가한다. 적합한기간의인큐베이션후, ELISA 플레이트를세척하고, 스클레로스틴검출시약을첨가하여, 코팅된항-스클레로스틴항체 ( 이경우에는 Ab-X임 ) 가특이적으로결합된스클레로스틴의양을측정한다. 검정을위한배경신호는코팅된항체 ( 이경우에는 Ab-X임 ), 액상의제2 항체 ( 이경우에는 Ab-Y임 ), 스클레로스틴완충액단독 ( 즉, 스클레로스틴이없음 ) 및스클레로스틴검출시약을함유하는웰에서얻어진신호로서정의된다. 검정을위한양성대조신호는코팅된항체 ( 이경우에는 Ab-X임 ), 액상의제2 항체완충액단독 ( 즉, 액상의제2 항체가없음 ), 스클레로스틴및스클레로스틴검출시약을함유하는웰에서얻어진신호로서정의된다. ELISA 검정은양성대조신호가배경신호의 6배이상인방식으로수행될필요가있다. 어떤항체를코팅항체로서사용하는지, 그리고어떤항체를제2의 ( 경쟁자 ) 항체로서사용하는지선택하는것으로부터발생하는임의의아티팩트 ( 예를들어, 스클레로스틴에대한 Ab-X의친화도와 Ab-Y의친화도가유의하게상이함 ) 를방지하기위해, 교차-차단검정은다음과같은 2가지방식으로수행될필요가있다 : 1) 방식 1: Ab-X가, ELISA 플레이트상에코팅된항체이고, Ab-Y가액상의경쟁자항체인경우 ; 및 2) 방식 2: Ab-Y가, ELISA 플레이트상에코팅된항체이고, Ab-X가액상의경쟁자항체인경우. 방식 1 또는 2에있어서, 액상의항-스클레로스틴항체의사용으로인해, 스클레로스틴검출신호 ( 즉, 코팅된항체가결합한스클레로스틴의양 ) 가, 액상의항-스클레로스틴항체의부재하에얻어진스클레로스틴검출신호 ( 즉, 양성대조웰 ) 에비해 60% 내지 100%, 구체적으로는 70% 내지 100%, 보다구체적으로는 80% 내지 100% 감소될수있는경우에 Ab-X 및 Ab-Y가교차-차단을하는것으로정의된다. 이와같은 ELISA-기반교차-차단검정의예는실시예 7 ("ELISA-기반교차-차단검정 ") 에서찾아볼수있다
85 [0793] [0794] [0795] [0796] [0797] [0798] [0799] 세포-기반중화검정시험관내골형성모델로서, 배양액중골모세포계세포 (1차세포또는세포주 ) 에의한무기질화가이용된다. 무기질화는 1종이상의분화제에의해골모세포계세포의분화가유도되는것으로부터출발하여약 1 내지 6주가소요된다. 전체적인일련의이벤트에는세포증식, 분화, 세포외매트릭스생성, 매트릭스성숙및최종적으로무기질침착 ( 칼슘포스페이트의결정화및 / 또는침착을의미함 ) 이포함된다. 본원에서는, 세포증식및분화로부터출발하여무기질의침착으로종료되는일련의이벤트가무기질화로지칭된다. 칼슘 ( 무기질 ) 의측정값이검정결과이다. MC3T3-E1 세포 ( 문헌 [Sudo H, Kodama H-A, Amagai Y, Yamamoto S, Kasai S In vitro differentiation and calcification in a new clonal osteogenic cell line derived from newborn mouse calvaria. J. Cell Biol. 96: ]) 및고유세포주의서브클론은분화제의존재하에성장시, 배양액중에서무기질을형성할수있다. 이러한서브클론으로는 MC3T3-E1-BF ( 문헌 [Smith E, Redman R, Logg C, Coetzee G, Kasahara N, Frenkel B Glucocorticoids inhibit developmental stage-specific osteoblast cell cycle. J. Biol. Chem. 275: ]) 가포함된다. 고유 MC3T3-E1 세포및 MC3T3-E1-BF 서브클론의경우, 스클레로스틴은무기질침착까지를비롯한일련의이벤트중하나이상을억제할수있다 ( 즉, 스클레로스틴은무기질화를억제함 ). 스클레로스틴의억제활성을중화시킬수있는항-스클레로스틴항체는스클레로스틴의존재하에서배양액중의무기질침착을가능하게하며, 이때칼슘포스페이트 ( 칼슘으로서측정됨 ) 가침착된양은스클레로스틴단독 ( 즉, 항체가없음 ) 의처리군에서측정된칼슘의양에비해통계적으로유의한수준으로많다. 도 22, 23 및 24에제시된세포-기반무기질침착검정실험에서사용되는항체는약 145 Kd의분자량을갖고, 항체분자당 2개의스클레로스틴결합부위를갖는다. 특정항-스클레로스틴항체또는항-스클레로스틴결합제가스클레로스틴을중화시킬수있는지여부 ( 즉, 스클레로스틴중화항체또는그의유도체, 또는스클레로스틴중화결합제인지여부 ) 를결정하기위한목적으로상기검정을수행하는경우, 검정에서사용된스클레로스틴의양은, 스클레로스틴단독의처리군에서측정된칼슘포스페이트 ( 칼슘으로서측정됨 ) 의침착수준이스클레로스틴비-처리군에비해 70% 이상 ( 통계적으로유의한수준 ) 높은최소량일필요가있다. 항-스클레로스틴중화항체또는항-스클레로스틴중화결합제는, 칼슘포스페이트 ( 칼슘으로서측정됨 ) 의침착수준이스클레로스틴단독 ( 즉, 항체및결합제가없음 ) 의처리군에비해통계적으로유의하게높은항-스클레로스틴중화항체또는항-스클레로스틴중화결합제로서정의된다. 항-스클레로스틴항체또는항-스클레로스틴결합제가중화항체인지여부를결정하기위해서는, 검정에서사용된항-스클레로스틴항체또는항-스클레로스틴결합제의양이, 웰당스클레로스틴결합부위의몰수가웰당스클레로스틴의몰수에비해과잉으로존재하는양일필요가있다. 요구될수있는과잉수준은항체의효력에따라 24, 18, 12, 6, 3 또는 1.5배일수있고, 당업자는둘이상의결합제농도를시험하는정형적인 (routine) 실시에대해친숙하다. 예를들어, 효력이높은항-스클레로스틴중화항체또는항-스클레로스틴중화결합제는, 웰당스클레로스틴결합부위의몰수가웰당스클레로스틴의몰수에비해심지어 6배미만의과잉수준으로존재하는경우에도스클레로스틴을중화시킬수있을것이다. 효력이낮은항-스클레로스틴중화항체또는항-스클레로스틴중화결합제는 12, 18 또는 24배의과잉수준에서만클레로스틴을중화시킬수있을것이다. 최대범위의효력을갖는스클레로스틴결합제가중화스클레로스틴결합제로서적합하다. 예시적인세포-기반무기질침착검정은실시예 8에상세하게기재되어있다. 인간스클레로스틴을중화시킬수있는항-스클레로스틴항체및그의유도체, 및인간스클레로스틴을중화시킬수있는스클레로스틴결합제는, 골형성의저하, 골무기질밀도의저하, 골무기질함량의저하, 골질량의저하, 골질의저하및골강도의저하중하나이상으로인한인간증상 / 장애, 또는골형성의저하, 골무기질밀도의저하, 골무기질함량의저하, 골질량의저하, 골질의저하및골강도의저하중하나이상과관련된인간증상 / 장애, 또는골형성의저하, 골무기질밀도의저하, 골무기질함량의저하, 골질량의저하, 골질의저하및골강도의저하중하나이상을유발하는인간증상 / 장애의치료에있어서유용할수있다. 생체내중화검정새로운골형성의자극과관련된각종파라미터의증가, 또는새로운골형성으로인한각종파라미터의증가는, 스클레로스틴을중화시킬수있고이에따라새로운골형성의자극을일으킬수있는결합제를식별하기위한생체내스클레로스틴결합제시험의결과로서측정될수있다. 이러한파라미터로는각종혈청동화작용마커 [ 예를들어, 오스테오칼신, P1NP (1형프로콜라겐의 n-말단프로펩티드 )], 골형성의골조직형태계측
86 마커 ( 예를들어, 골모세포표면 / 골표면 ; 골형성속도 / 골표면 ; 골주두께 ), 골무기질밀도, 골무기질함량, 골질량, 골질및골강도가포함된다. 스클레로스틴중화결합제는, 새로운골형성의자극과관련된임의의파라미터, 또는새로운골형성으로인한임의의파라미터가비히클-처리동물의경우에비해통계적으로유의하게증가되는결합제로서정의된다. 이러한생체내시험은임의의적합한포유동물 ( 예를들어, 마우스, 래트, 원숭이 ) 에서수행될수있다. 상기생체내시험의예는실시예 5 (" 항-스클레로스틴모노클로날항체의생체내시험 ") 에서찾아볼수있다. [0800] [0801] [0802] [0803] [0804] [0805] [0806] 스클레로스틴의아미노산서열이포유동물종을통틀어 100% 동일하지는않으나 ( 예를들어, 마우스스클레로스틴은인간스클레로스틴과 100% 동일하지는않음 ), 당업자는생체내에서특정종 ( 예를들어, 마우스 ) 의스클레로스틴을중화시킬수있으면서시험관내에서인간스클레로스틴에결합할수있는스클레로스틴결합제가생체내에서인간스클레로스틴을중화시킬수있는가능성이높다는점을알것이다. 따라서, 이러한인간스클레로스틴결합제 ( 예를들어, 항-인간스클레로스틴항체 ) 는골형성의저하, 골무기질밀도의저하, 골무기질함량의저하, 골질량의저하, 골질의저하및골강도의저하중하나이상으로인한인간증상 / 장애, 또는골형성의저하, 골무기질밀도의저하, 골무기질함량의저하, 골질량의저하, 골질의저하및골강도의저하중하나이상과관련된인간증상 / 장애, 또는골형성의저하, 골무기질밀도의저하, 골무기질함량의저하, 골질량의저하, 골질의저하및골강도의저하중하나이상을유발하는인간증상 / 장애의치료에있어서유용할수있다. 마우스스클레로스틴유전자를삭제하고그위치에인간스클레로스틴유전자를삽입하기위해동종재조합이이용된마우스 ( 즉, 인간스클레로스틴유전자녹-인마우스또는인간 SOST 녹-인마우스 ) 는또다른생체내시스템의일례이다. 본발명은, 예를들어항체 Ab-A, Ab-B, Ab-C, Ab-D 및 Ab-1 내지 Ab-24와인간스클레로스틴의결합을교차- 차단하는상기기재된결합제들중하나를제약상허용되거나생리학상허용되는담체, 부형제또는희석제와함께포함하는제약조성물을제공한다. 제약조성물및치료방법은동시계류중인미국출원일련번호제 10/868,497호 (2004년 6월 16일자로출원되었으며, 미국출원일련번호제60/478,977호를우선권으로주장함 ) 에개시되어있고, 상기두출원은본원에참고문헌으로포함된다. 각종치료요법 ( 예를들어, 피하, 경구, 비경구, 정맥내, 비내및근육내투여및제제화포함 ) 중에서, 본원에기재된특정조성물을사용하기위해개발된적합한투여및치료요법은당업계에잘알려져있으며, 이들의일부는일반적인예시의목적으로아래에서간략하게논의된다. 특정용도에서, 본원에개시된제약조성물은경구투여를통해동물에게전달될수있다. 이와같이, 상기조성물은불활성희석제또는동화성 (assimilable) 식용담체와함께제제화될수있거나, 또는경질또는연질젤라틴캡슐중에봉입될수있거나, 또는정제로압축될수있거나, 또는식품과함께직접복용될수있다. 특정상황에서는, 본원에개시된제약조성물을피하, 비경구, 정맥내, 근육내또는심지어복강내로전달하는것이바람직할수있다. 이러한방법은당업자에게잘알려져있으며, 이들의일부가예를들어, US 5,543,158; US 5,641,515 및 US 5,399,363에보다상세하게기재되어있다. 특정실시양태에서, 유리염기또는약리학상허용되는염으로서의활성화합물의용액은, 계면활성제, 예를들어히드록시프로필셀룰로스와적합하게혼합된물중에서제조될수있다. 또한, 글리세롤, 액체폴리에틸렌글리콜및이들의혼합물, 및오일중에서분산액을제조할수있다. 통상적인저장및사용조건의경우, 이들제제는일반적으로미생물의성장을방지하기위한보존제를함유할것이다. 주사용으로적합한예시적인제약형태로는멸균수용액또는분산액, 및멸균주사용용액또는분산액의즉석제조를위한멸균분말 ( 예를들어, US 5,466,468 참조 ) 이포함된다. 모든경우에서, 상기제약형태는멸균상태여야하며, 주사가용이한정도의유체상태이어야한다. 상기제약형태는제조및저장조건에서안정해야하고, 미생물 ( 예를들어, 박테리아및진균류 ) 의오염작용에대항하여보존되어야한다. 담체는용매또는분산매질 ( 예를들어, 물, 에탄올, 폴리올 ( 예를들어, 글리세롤, 프로필렌글리콜, 액체폴리에틸렌글리콜등 ), 이들의적합한혼합물, 및 / 또는식물성오일함유 ) 일수있다. 예를들어, 코팅 ( 예를들어, 레시틴 ) 의사용, 분산액의경우에필요한입자크기의유지및 / 또는계면활성제의사용을통해적절한유동성이유지될수있다. 미생물작용의예방은각종항박테리아제및항진균제, 예를들어파라벤, 클로로부탄올, 페놀, 소르브산, 티메로살등에의해촉진될수있다. 많은경우에서, 제약형태가등장화제, 예를들어당또는염화나트륨을포함하는것이바람직할것이다. 주사용조성물의흡수지연은조성물중에서흡수지연물질 ( 예를들어, 알루미늄모노스테아레이트및젤라틴 ) 을사용함으로써달성될수있다. 한실시양태에서, 수용액의비경구투여의경우, 상기용액은필요한경우, 적합하게완충되어야하고, 우선액
87 체희석제가충분한염수또는글루코스에의해등장성이되어야한다. 이러한특정수용액은정맥내, 근육내, 피하및복강내투여에특히적합하다. 이와관련하여, 당업자는본발명에비추어사용될수있는멸균수성매질을알것이다. 예를들어, 1회의투여량은 1 ml의등장성 NaCl 용액에용해되어, 1000 ml의피하주사액 (hypodermoclysis fluid) 에첨가되거나제안된주입부위에주사될수있다 ( 예를들어, 문헌 [Remington's Pharmaceutical Sciences, 15th ed., pp , ] 참조 ). 물론, 치료할대상체의상태에따라투여량이어느정도달라질것이다. 또한, 인간투여의경우, 미국 FDA 생물제제표준연구소가요구하는멸균성, 발열원성, 일반안전성및순도표준을충족시키는것이물론바람직할것이다. [0807] [0808] [0809] [0810] [0811] [0812] [0813] [0814] 본발명의또다른실시양태에서, 본원에개시된조성물은중성또는염형태로제조될수있다. 제약상허용되는염의예로는산부가염 ( 단백질의유리아미노기에의해형성됨 ) 이포함되며, 이들은무기산, 예를들어염산또는인산, 또는유기산, 예를들어아세트산, 옥살산, 타르타르산, 만델산등에의해형성된다. 또한, 유리카르복실기와의염은무기염기, 예를들어수산화나트륨, 수산화칼륨, 수산화암모늄, 수산화칼슘또는수산화철, 및유기염기, 예를들어이소프로필아민, 트리메틸아민, 히스티딘, 프로카인등으로부터유도될수있다. 중성또는염형태로제조된용액은그투여용제제의경우와부합하는방식으로치료상유효한양으로투여될것이다. 담체는임의의모든용매, 분산매질, 비히클, 코팅, 희석제, 항박테리아제및항진균제, 등장화제및흡수지연제, 완충액, 담체용액, 현탁액, 콜로이드등을추가로포함할수있다. 제약활성물질을위한이러한매질및작용제를사용하는것은당업계에잘알려져있다. 임의의통상적인매질또는작용제가치료용조성물에서사용되는것이고려된다 ( 활성성분과비상용성인경우는제외 ). 또한, 보충활성성분이조성물에혼입될수있다. " 제약상허용되는 " 이란구절은, 분자물질또는조성물이인간에게투여되었을때알레르기성반응또는유사한부적절반응이나타나지않는경우를의미한다. 특정실시양태에서는, 본발명의조성물을적합한숙주세포 / 유기체에투여하기위해리포좀, 나노캡슐, 마이크로입자, 지질입자, 소낭등이사용된다. 특히, 본발명의조성물은지질입자, 리포좀, 소낭, 나노구체또는나노입자등중에둘러싸여전달되도록제제화될수있다. 별법으로, 본발명의조성물은담체비히클의표면에공유결합되거나공유결합이아닌방식으로결합될수있다. 일반적으로, 잠재적인약물담체로서의리포좀및리포좀-유사제제의형성및사용은당업자에게알려져있다 ( 예를들어, 문헌 [Lasic, Trends Biotechnol. 16(7):307-21, 1998]; [Takakura, Nippon Rinsho 56(3):691-95, 1998]; [Chandran et al., Indian J. Exp. Biol. 55(8): , 1997]; [Margalit, Crit. Rev. Ther. Drug Carrier Syst. 12(2-3):233-61, 1995]; US 5,567,434; US 5,552,157; US 5,565,213; US 5,738,868 및 US 5,795,587 참조 ( 이들문헌은각각그전문이본원에구체적으로포함됨 )). 리포좀을사용하는경우는전신적전달후에자가면역성반응또는허용될수없는독성과관련이있는것으로보이지않는다. 특정실시양태에서, 수성매질에분산되어자발적으로다중막동심성겹층소낭 (multilamellar concentric bilayer vesicle) ( 다중막소낭 (MLV) 으로도지칭됨 ) 을형성하는인지질로부터리포좀이형성된다. 또한, 다른실시양태에서, 본발명은본발명의조성물의제약상허용되는나노캡슐제제를제공한다. 일반적으로, 나노캡슐은안정하고재현가능한방식으로화합물을포획할수있다 ( 예를들어, 문헌 [Quintanar- Guerrero et al., Drug Dev. Ind. Pharm. 24(12): , 1998] 참조 ). 세포내중합체의과부하로인한부작용을방지하기위해, 생체내에서소화될수있는중합체를이용하여약 0.1 μm크기의초미세입자를설계할수있다. 이러한입자는예를들어, 문헌 [Couvreur et al., Crit. Rev. Ther. Drug Carrier Syst. 5(1):1-20, 1988]; [zur Muhlen et al., Eur. J. Pharm. Biopharm. 45(2):149-55, 1998]; [Zambaux et al., J. Controlled Release 50(1-3):31-40, 1998]; 및 US 5,145,684에기재된바와같이제조될수있다. 또한, 본발명의제약조성물은, 제약조성물의사용에관한설명을제공하는패키징재료와함께용기내에포함될수있다. 일반적으로, 이러한설명에는시약농도뿐만아니라특정실시양태에서제약조성물의재구성에필요할수있는부형제성분또는희석제 ( 예를들어, 물, 염수또는 PBS) 의상대적인양을기술하는명확한표현이포함될것이다. 투여되는양은체중 1 kg 당 0.01 내지 100 mg의범위일수있다. 물론, 투여량및투여빈도는치료할증상의특성및중증도, 목적하는반응, 환자의상태등에따라달라질것이며, 이는당업자에게명백할것이다. 통상적으로, 상기조성물은상기명시된바와같이다양한기술에의해투여될수있다. 골무기질함량및 / 또는골무기질밀도의증가수준은, X선의사용 ( 예를들어, 이중에너지 X선흡수측정법
88 (Dual Energy X-ray Absorptometry; "DEXA") 을통해, 또는 1) 골형성및 / 또는골모세포활성의마커, 예를들어골모세포특이적알칼리성포스파타제, 오스테오칼신, 1형프로콜라겐 C' 프로펩티드 (PICP), 전알칼리성포스파타제 ( 문헌 [Comier, Curr. Opin. in Rheu. 7:243(1995)] 참조 ) 및혈청프로콜라겐 1 N-말단프로펩티드 (P1NP) ( 이에제한되지는않음 ) 및 / 또는 2) 골재흡수및 / 또는골모세포활성의마커, 예를들어피리디놀린, 데옥시피리디놀린, N-텔로펩티드, 요 (urinary) 히드록시프롤린, 혈장타르트레이트-내성산포스파타제, 및갈락토실히드록시라이신 ; ( 상기코미어 (Comier) 의문헌참조 ), 혈청 TRAP 5b ( 타르트네이트-내성산포스파타제동형체 (isoform) 5b) 및혈청가교된 C-텔로펩티드 (sctxi) ( 이에제한되지는않음 ) 의측정을통한추정에의해직접적으로측정될수있다. 또한, 골질량은체중으로부터계산되거나여타방법에의해계산될수있다 ( 문헌 [Guinness-Hey, Metab. Bone Dis. Relat. Res. 5: , 1984] 참조 ). 예를들어, 골다공증및골감소증과같은인간질환의증상과유사한골손실, 골재흡수, 골형성, 골강도또는골무기질침착의파라미터들에대한본발명의조성물및방법의효과를시험하기위해동물및특정동물모델이이용된다. 이러한모델의예로는난소-절제된래트모델 ( 문헌 [Kalu, D.N., The ovariectomized rat model of postmenopausal bone loss. Bone and Mineral 15: (1991)]; [Frost, H.M. and Jee, W.S.S. On the rat model of human osteopenias and osteoporosis. Bone and Mineral 18: (1992)]; 및 [Jee, W.S.S. and Yao, W., Overview: animal models of osteopnia and osteoporosis. J. Musculoskel. Neuron. Interact. 1: (2001)]) 이포함된다. [0815] [0816] [0817] [0818] [0819] 본발명의조성물에의해치료될수있는구체적인증상으로는, 골의성장또는발생이비정상적인이형성증 (dysplasia), 및골감소증, 골다공증및골손실의각종원인이포함된다. 이러한증상의대표적인예로는연골무형성증, 쇄골두개골이골증, 연골종증, 섬유상이형성증, 고쉐 (Gaucher) 질환, 저포스페이트혈성구루병, 마르판 (Marfan) 증후군, 다발성유전성외골증, 신경섬유종증, 불완전골생성증, 골화석증, 골반문증, 경화성병변, 가관절증, 및화농성골수염, 치주질환, 항간질성약물-유발골손실, 원발성및속발성부갑상선기능항진, 가족성부갑상선기능항진증후군, 체중감소-유발골손실, 남성골다공증, 폐경후골손실, 골관절염, 신성골이영양증, 침윤성골장애, 경구골손실, 턱의골괴사, 연소성파제트 (Paget) 질환, 유선상과골증, 대사성골질환, 비만세포증, 겸상적혈구빈혈 / 질환, 장기이식-관련골손실, 신장이식-관련골손실, 전신성홍반성루푸스, 강직성척추염, 간질, 연소성관절염, 지중해빈혈, 점액다당류증, 파브리 (Fabry) 질환, 터너 (Turner) 증후군, 다운 (Down) 증후군, 클라인펠터 (Klinefelter) 증후군, 나병, 페르테스 (Perthes) 질환, 청년기특발성척주측만증, 영아발병성다기관염증성질환, 윈체스터 (Winchester) 증후군, 멘케스 (Menkes) 질환, 윌슨 (Wilson) 질환, 허혈성골질환 ( 예, 레그-칼베-페르테스 (Legg-Calve-Perthes) 질환, 국부이동성골다공증 ), 빈혈상태, 스테로이드에의해유발된증상, 글루코코르티코이드- 유발골손실, 헤파린-유발골손실, 골수장애, 괴혈병, 영양실조, 칼슘결핍, 특발성골감소증또는골다공증, 선천성골감소증또는골다공증, 알콜중독, 만성간질환, 폐경후상태, 만성염증성증상, 류마티스성관절염, 염증성장질환, 궤양성대장염, 염증성대장염, 크론 (Crohn) 질환, 희발월경, 무월경, 임신, 당뇨병, 갑상선기능항진, 갑상선장애, 부갑상선장애, 쿠싱 (Cushing) 질환, 말단비대증, 성선기능저하증, 부동화또는무위 (disuse), 반사교감신경이상증후군, 국부골다공증, 골연화증, 인공관절과관련된골손실, HIV-관련골손실, 성장호르몬의손실과관련된골손실, 낭성섬유증과관련된골손실, 섬유상이형성증, 화학요법-관련골손실, 종양-유발골손실, 암-관련골손실, 호르몬절제골손실, 다발성골수종, 약물-유발골손실, 신경성거식증, 질환-관련안면골손실, 질환-관련머리뼈 (cranial bone) 손실, 질환-관련악골손실, 질환-관련두개골 (skull bone) 손실, 우주여행과관련된골손실이포함된다. 추가적인증상으로는노화와관련된골손실, 예를들어노화와관련된안면골손실, 노화와관련된머리뼈손실, 노화와관련된악골손실, 및노화와관련된두개골손실이포함된다. 또한, 본발명의조성물은정형외과시술, 치과시술, 이식수술, 관절대체, 골이식, 골미용수술및골복구, 예를들어골절치유, 불유합치유, 지연유합치유및안면재건술의결과를개선하는데유용할수있다. 시술, 대체, 이식, 수술또는복구동안에, 또는그전후에 1종이상의조성물이투여될수있다. 또한, 본발명은 1종이상의본발명에따른항-스클레로스틴결합제를포함하는진단키트를제공한다. 결합제는항체일수있다. 또한, 상기키트는다음중하나이상을임의로포함할수있다 : (1) 스크리닝, 진단, 예후, 치료모니터링또는이들용도의임의조합을위해 1종이상의결합제 ( 들 ) 의사용설명서 ; (2) 항-스클레로스틴결합제 ( 들 ) 에대한표지된결합파트너 ;
89 [0820] [0821] [0822] [0823] [0824] [0825] [0826] [0827] [0828] (3) 항-스클레로스틴결합제 ( 들 ) 가고정화된고체상 ( 예를들어, 시약스트립 ); 및 (4) 스크리닝, 진단, 예후, 치료모니터링또는이들용도의임의조합에대한규정승인을명시하는라벨또는삽입물. 결합제 ( 들 ) 에대한표지된결합파트너가없는경우, 결합제 ( 들 ) 자체가 1종이상의검출가능한마커 ( 들 ), 예를들어화학발광잔기, 효소잔기, 형광잔기또는방사성잔기로표지될수있다. 하기실시예는제한이아닌예시를목적으로한다. [ 실시예 ] 실시예 1 스클레로스틴의재조합발현재조합인간스클레로스틴 /SOST는알앤디시스템즈 ( 미국미네소타주미니애폴리스 ; 2006 cat# 1406-ST-025) 로부터구입할수있다. 재조합마우스스클레로스틴 /SOST도알앤디시스템즈 ( 미국미네소타주미니애폴리스 ; 2006 cat# 1589-ST-025) 로부터구입할수있다. 별법으로, 상이한종의스클레로스틴이무혈청현탁액에적합화된 293T 또는 293EBNA 세포에서일시적으로발현될수있다. 형질감염은 500 ml 또는 1 L 배양액에서수행될수있다. 다음시약및재료는기브코 (Gibco) BRL ( 현재미국캘리포니아주칼스배드에소재한인비트로젠 (Invitrogen) 임 ) 로부터구입할수있다. 카탈로그번호는괄호안에나열되어있다 : 무혈청 DMEM ( ); DMEM/F12 (3:1) (21068/11765); 1X 인슐린-트랜스페린-셀레늄보충물 ( ); 1X Pen Strep Glut ( ); 2 mm L-글루타민 ( ); 20 mm HEPES ( ); 0.01% 플루로닉 (Pluronic) F68 ( ). 요약하면, 세포접종물 ( 세포 /ml 배양액부피 ) 을 10 분간 4 에서 2,500 RPM 으로원심분리하여조건화배지를분리하였다. [0829] 세포를무혈청 DMEM에재현탁시키고, 10분간 4 에서 2,500 RPM으로다시원심분리하였다. 세척용액을흡인제거한후, 세포를성장배지 [DMEM/F12 (3:1) + 1X 인슐린-트랜스퍼린-셀레늄보충물 + 1X Pen Strep Glut + 2 mm L-글루타민 + 20 mm HEPES % 플루로닉 F68] 에재현탁시켰다 (1 L 또는 3 L 스피너플라스크배양 ). 가습인큐베이터 (37 및 5% CO 2 유지 ) 내에있는자석교반플레이트 (125 RPM) 상에서스피너플라 스크배양을유지시켰다. 50 ml 원뿔형튜브중에서, 포유동물발현플라스미드 DNA ( 예를들어, pcdna3.1, pcep4, 미국캘리포니아주칼스배드에소재한인비트로젠라이프테크놀로지스 (Invitrogen Life Technologies) [ 스클레로스틴의완전한코딩영역 ( 및정지코돈 ) 과함께코작 (Kozak) 공통서열 ( 예를들어, CCACC) ( 출발부위 ATG의 5' 방향 ) 함유 ] 및형질감염시약의복합체를형성하였다. [0830] [0831] [0832] [0833] [0834] [0835] DNA-형질감염시약복합체는무혈청 DMEM 또는 OPTI-MEM 중에서최종배양액부피의 5 내지 10% 로제조될수있다. 이러한목적으로사용될수있는형질감염시약으로는엑스-트림젠 (X-tremeGene) RO-1539 ( 미국인디애나주인디애나폴리스에소재한로쉐어플라이드사이언스 (Roche Applied Science)), 푸젠6 (FuGene6) ( 미국인디애나주인디애나폴리스에소재한로쉐어플라이드사이언스 ), 리포펙타민 (Lipofectamine) 2000 ( 미국캘리포니아주칼스배드에소재한인비트로젠 ) 및 293펙틴 (293fectin) ( 미국캘리포니아주칼스배드에소재한인비트로젠 ) 이포함된다. 우선, 1 내지 5 μg의플라스미드 DNA ( 배양액 1 ml 당 ) 를무혈청 DMEM에첨가한후, 1 내지 5 μl의형질감염시약 ( 배양액 1 ml 당 ) 을첨가하였다. 복합체는약 10 내지 30분간실온에서인큐베이션된후에스피너플라스크의세포에첨가될수있었다. 형질감염 / 발현은 4 내지 7일간수행될수있었고, 이후에조건화배지 (CM) 를 60분간 4 에서원심분리 (4,000 RPM) 에의해수거하였다. 실시예 2 재조합스클레로스틴의정제포유동물숙주세포로부터재조합스클레로스틴을다음과같이정제하였다. 모든정제공정은실온에서수행하였다. 뮤린 (murine) 및인간스클레로스틴을비롯한각종스클레로스틴을정제하기위한정제계획을수행하였다. 상기정제계획에서는친화도크로마토그래피에이어양이온교환크로마토그래피가이용되었다. 헤파린크로마토그래피포유동물숙주세포조건화배지 (CM) 를베크만 (Beckman) J6-M1 원심분리기에의해원심분리하여 (1시간, 4, 4000 rpm) 세포파편을분리하였다. 이후, CM 상층액을멸균 0.2 μm여과기를통해여과하였다. ( 이때,
90 멸균여과된 CM은정제단계전까지임의로냉동저장될수있다.) CM이냉동된경우, 이를다음과같은온도또는이들을조합한온도에서해동시켰다 : 4, 실온또는온수. 해동후, CM을멸균 0.2 μm여과기를통해여과하고, 임의로분자량 10 kd의컷-오프막을이용한접촉유동한외여과 (tangential flow ultrafiltration; TFF) 에의해농축하였다. CM 농축물을멸균 0.2 μm여과기를통해여과하고, PBS 중에서평형화된헤파린고성능 ( 헤파린 HP) 컬럼 [ 지이헬스케어 (GE Healthcare; 이전회사명 : 아머샴바이오사이언시스 (Amersham Biosciences))] 상에로딩하였다. 별법으로, 여과된 CM 상층액을, PBS 중에서평형화된헤파린 HP 컬럼상에직접로딩할수있다. [0836] [0837] [0838] [0839] [0840] [0841] [0842] [0843] [0844] [0845] 로딩후, 흘러나온배출액의 280 nm에서의흡광도가기준값 ( 즉, CM 상층액로딩전에측정한흡광도 ) 으로복귀될때까지헤파린 HP 컬럼을 PBS로세척하였다. 이후, 선형구배 (150 mm 2 M 염화나트륨 (PBS 중 )) 를이용하여컬럼으로부터스클레로스틴을용출시켰다. 용출액의 280 nm에서의흡광도를모니터링하고, 단백질-함유분획을수집하였다. 이후, 분획을코마시 (Coomassie)-염색 SDS-PAGE에의해분석하여, 글리코실화스클레로스틴의크기로이동하는폴리펩티드를함유하는분획을식별하였다. 컬럼으로부터의적절한분획들을합하여헤파린 HP 풀을생성하였다. 양이온교환크로마토그래피헤파린 HP 컬럼으로부터용출된스클레로스틴을 SP 고성능 (SPHP) 크로마토그래피매질을이용한양이온교환크로마토그래피 ( 지이헬스케어 ; 이전회사명 : 아머샴바이오사이언시스 ) 에의해추가로정제하였다. 10,000 MWCO 막 ( 피어스 (Pierce) 의슬라이드-어-라이저 (Slide-A-Lyzer)) 을이용한투석에의해헤파린 HP 풀을 PBS 로완충교환하였다. 이후, 투석된헤파린 HP 풀을, PBS 중에서평형화된 SPHP 컬럼상에로딩하였다. 로딩후, 흘러나온배출액의 280 nm에서의흡광도가기준값으로복귀될때까지헤파린 HP 컬럼을 PBS로세척하였다. 이후, 선형구배 (150 mm 1 M 염화나트륨 (PBS 중 )) 를이용하여 SPHP 컬럼으로부터스클레로스틴을용출시켰다. 용출액의 280 nm에서의흡광도를모니터링하고, 용출된스클레로스틴을분획으로수집하였다. 이후, 분획을코마시-염색 SDS-PAGE에의해분석하여, 글리코실화스클레로스틴의크기로이동하는폴리펩티드를함유하는분획을식별하였다. 컬럼으로부터의적절한분획들을합하여 SPHP 풀을생성하였다. 제제화정제후, 10,000 MWCO 막 ( 피어스의슬라이드-어-라이저 ) 을이용한투석에의해헤파린 HP 풀을 PBS 중에서제제화시켰다. 스클레로스틴의농축이필요한경우, 원심분리장치 ( 아미콘센트리콘 (Centricon) 또는센트리프렙 (Centriprep)) 및 10,000 MWCO 막을이용하였다. 제제화후, 스클레로스틴을멸균 0.2 μm여과기를통해여과하고, 40 에서저장하거나냉동시켰다. 실시예 3 펩티드결합 ELISA 래트스클레로스틴의공지된아미노산서열 ( 서열 98) 을기초로하여일련의중첩펩티드 ( 각펩티드의길이 : 약 20-25개의아미노산 ) 를합성하였다. 모든펩티드는감소된시스테인잔기를함유하도록설계되었고, 추가의시스테인이각펩티드의 C-말단에포함되었다 ( 아직까지는서열중에시스테인이함유되지않음 ). 이로써, 펩티드가공유커플링에의해분석용플레이트에결합할수있었다 ( 시판중인술프히드릴결합플레이트 ( 코스타 (Costar)) 사용, 농도 : 1 μg /ml, 포스페이트완충염수 (PBS: ph 6.5, 1 mm EDTA 함유 ) 중 ). 플레이트를 1시간동안실온에서인큐베이션한후, PBS (0.5% 트윈 (Tween) 20 함유 ) 로 3회세척하였다. 플레이트를 30분간실온에서 PBS 용액 (0.5% 피쉬스킨젤라틴 ( 시그마 (Sigma)) 함유 ) 과함께인큐베이션함으로써차단시킨후, 0.5% 트윈 20을함유하는 PBS로 3회세척하였다. 시험할항체를 PBS (0.5% 피쉬스킨젤라틴함유 ) 중에 1 μg /ml로희석시키고, 1시간동안실온에서펩티드-코팅플레이트와함께인큐베이션하였다. 과잉의항체를 PBS (0.5% 트윈 20 함유 ) 로 3회세척하여제거하였다. 이후, 호스래디쉬퍼옥시다제 (horseradish peroxidase) (0.5% 트윈 20을함유하는 PBS 중에적절하게희석됨 ) 에컨쥬게이션되고해당항체에결합할수있는적절한제2 항체와함께플레이트를인큐베이션하였다. 이후, 플레이트를 3회세척하였다 (1회: 0.5% 트윈 20을함유하는 PBS, 2회 : PBS). 최종적으로, 플레이트를 5 분간실온에서호스래디쉬퍼옥시다제발색성기질 (TMB-Stable Stop, RDI) 과함께인큐베이션하였고, 산으로발색을중지시키고, 플레이트의광학밀도를 450 nm에서측정하였다. 재료
91 [0846] [0847] [0848] [0849] [0850] [0851] [0852] [0853] [0854] [0855] [0856] [0857] [0858] [0859] [0860] [0861] [0862] [0863] [0864] [0865] [0866] [0867] [0868] [0869] [0870] [0871] [0872] [0873] [0874] [0875] [0876] [0877] 코스타의술프히드릴결합플레이트 (VWR# ) 코팅완충액 : 1X PBS ph mm EDTA 차단완충액 : 1X PBS + 0.5% 피쉬스킨젤라틴 (CS의 PBS; 시그마 # G7765의 FSG) 세척완충액 : 1X PBS + 0.5% 트윈 20 래트스클레로스틴펩티드항체샘플 : 일시적 Ab, 정제된재조합 Ab, 토끼혈청등적절한제2 Ab: 염소-항-토끼 / 마우스-HRP ( 잭슨이뮤노리서치 (Jackson Immuno Research), ) TMB-Stable Stop (RDI# RDI-TMBSX-IL) 방법 : 1. 플레이트를 1OO μl / 웰의래트스클레로스틴펩티드 (1X PBS ph mm EDTA 중에 1 μg /ml로희석됨 ) 로코팅하였다. 플레이트를 1시간동안실온에서인큐베이션하였다. ( 플레이트는개봉후 30분내에사용되어야한다.) 2. 플레이트를세척완충액으로 3회세척하였다. 3. 플레이트를 200 μl / 웰차단완충액으로차단하였다. 플레이트를 30분간실온에서인큐베이션하였다. 4. (2) 에기재된바와같은세척을반복하였다. 5. 플레이트를차단완충액중에 1 μg /ml로희석된샘플 50 μl / 웰과함께인큐베이션하였다 [ 혈청역가는 1:100 에서출발함 ; 일시적재조합 Ab를그대로사용함 ; 정제된재조합 Ab를사용함 ] ( 모든샘플을 2회반복수행함 ). 플레이트를 1시간동안실온에서인큐베이션하였다. 6. (2) 에기재된바와같이플레이트를세척하였다. 7. 플레이트를차단완충액중에 1:1600으로희석된적절한제2 항체 (HRP 표지됨 ) (50 μl / 웰 ) 와함께인큐베이션하였다. 플레이트를 1시간동안실온에서인큐베이션하였다. 8. 플레이트를 1X 세척완충액및 2X PBS로세척하였다. 9. 플레이트를 5분간실온에서 TMB 50 μl / 웰과함께인큐베이션하였다 μl / 웰의 0.5 M HCl로반응을중지시켰다 nm 파장에서플레이트를판독하였다. 다음펩티드서열을상기기재된바와같이스크리닝하였다 : QGWQAFKNDATEIIPGLREYPEPP ( 서열 82) TEIIPGLREYPEPPQELENN ( 서열 83) PEPPQELENNQTMNRAENGG ( 서열 84) ENGGRPPHHPYDTKDVSEYS ( 서열 85) CRELHYTRFVTDGP ( 서열 86) CRELHYTRFVTDGPSRSAKPVTELV ( 서열 87) CRSAKPVTELVSSGQSGPRARLL ( 서열 88) CGPARLLPNAIGRVKWWRPNGPDFR ( 서열 89) RAQRVQLLCPGGAAPRSRKV ( 서열 90) PGGAAPRSRKVRLVAS ( 서열 91) KRLTRFHNQSELKDFGPETARPQ ( 서열 92)
92 [0878] [0879] [0880] [0881] [0882] [0883] [0884] [0885] [0886] [0887] [0888] [0889] [0890] [0891] [0892] [0893] [0894] [0895] IPDRYAQRVQLLSPGG ( 서열 93) SELKDFGPETARPQKGRKPRPRAR ( 서열 94) KGRKPRPRARGAKANQAELENAY ( 서열 95) PNAIGRVKWWRPNGPDFR ( 서열 96) KWWRPNGPDFRCIPDRYRAQRV ( 서열 97). 친화도가높은중화항체 (Ab-19) 가 2개의중첩펩티드서열, 즉 PNAIGRVKWWRPNGPDFR ( 서열 96) 및 KWWRPNGPDFRCIPDRYRAQRV ( 서열 97) 에결합하였다. 상기절차를통해, 외견상의선형에피토프와반응하는항체에대한에피토프를인식할수있다. 항체결합부위의일부또는전부를함유하는펩티드는항체에결합할것이며, 따라서검출될것이다. 실시예 4 인간스클레로스틴에피토프의식별스클레로스틴구조성숙형태 ( 신호펩티드는제거됨 ) 의인간스클레로스틴은 190개아미노산의단백질이다 ( 도 8). 도 9는 N-말단암 (arm) (N-말단 Q 시스테인1) 및 C-말단암 ( 시스테인8 말단 Y) 을갖는스클레로스틴의일반구조를나타내는모식도이다. 두암사이에는시스테인-매듭구조및 3개의루프 ( 루프 1, 루프 2 및루프 3으로지칭됨 ) 가샌드위치되어있다. 스클레로스틴에서, 4개의디술피드결합은서열 57-위치의 Cys1과서열 111-위치의 Cys5의결합 (C1-C5로지칭됨 ), 서열 71-위치의 Cys2와서열 125-위치의 Cys6의결합 (C2-C6으로지칭됨 ), 서열 82-위치의 Cys3과서열 142-위치의 Cys7의결합 (C3-C7로지칭됨 ), 및서열 86-위치의 Cys4와서열 144-위치의 Cys8의결합 (C4-C8로지칭됨 ) 이다. 8원고리구조는 C3-C7 및 C4-C8 디술피드결합을통해형성된다. 이러한고리구조는고리를관통하는 C1-C5 디술피드결합과함께통상적인시스테인-매듭을형성한다. 시스테인-매듭의일부가아닌 C2-C6은 2개의거대루프구조, 서로근접해있는루프 1 ( 잔기 57 잔기 82) 및루프 3 ( 잔기 111 잔기 142) 을형성한다. 루프 2는 C4 ( 잔기 86) C5 ( 잔기 111) 이다. 실험항-스클레로스틴모노클로날항체가결합하는에피토프의특징분석을위한일반적인방법에는, 인간스클레로스틴을여러프로테아제로단편화시키는단계, 각종인간스클레로스틴펩티드의서열을결정하는단계, 이들펩티드를단리하는단계, 및비아코어-기반 " 인간스클레로스틴펩티드에피토프경쟁결합검정법 " 을이용하여, 각펩티드가특정모노클로날항체에결합하는능력에대해시험하는단계가포함되었다. 생성된데이타로부터결합에피토프의위치를결정할수있었다. 펩티드소화물에대하여 HPLC 펩티드맵핑을수행하였다 ( 개별피크를수집하고, 펩티드를식별하고, 매트릭스- 보조레이저이탈질량분광법 (MALDI-MS) 및전자분무이온화 LC-MS (ESI-LC-MS) 분석법및 / 또는 N-말단시퀀싱에의해맵핑함 ). 상기연구에서의모든 HPLC 분석은역상 C8 컬럼 (2.1 mm i.d. 15 cm 길이 ) 을이용하여수행하였다. HPLC 펩티드맵핑은 0.05% 트리플루오로아세트산 ( 이동상 A) 0.05% 트리플루오로아세트산중 90% 아세토니트릴의선형구배를이용하여수행하였다. 컬럼은 50분에걸쳐 0.2 ml/ 분의유속으로전개되었다. 트립신및 AspN 엔도프로테이나제소화성숙형태의인간스클레로스틴을트립신 ( 아르기닌및라이신처리후에소화됨 ) 또는 AspN으로소화하였다. 약 200 μg의스클레로스틴 (0.5 내지 1.0 mg/ml) 을 20 시간동안 37 에서 8 μg의트립신또는 AspN과함께 PBS (ph 7.2) 중에서인큐베이션하였다. 트립신소화트립신소화물을 HPLC 크로마토그래피에의해처리한결과, 여러개의주요피크가나타났다 ( 도 10A). 트립신소화후에 HPLC로부터회수된펩티드피크에대한서열분석을수행하였다. 또한, 펩티드소화물의온라인 (on-line) ESI LC-MS 검정을수행하여 HPLC에의해분리된펩티드의정확한질량을측정하였다. 이에따라, 펩티드피크에존재하는펩티드들을식별하였다 ( 도 11). 도 13은스클레로스틴서열을따라정렬된각종펩티드
93 서열 (T19.2, T20, T20.6, T21-22) 을나타낸다. 각 T 뒤에있는숫자 ( 예를들어, T19.2) 는체류시간을반영한다. T19.2는 C2-C6 디술피드결합에의해연결된 2개의펩티드 ( 루프 1로부터의 1개펩티드및루프 3으로부터의 1개펩티드 ) 를함유한다. T20은시스테인-매듭구조에의해서로고정된 2개의펩티드를함유한다 ( 루프 1 및 3이그대로 C2-C6 디술피드에의해서로고정되고, 루프 2의대부분은포함되지않음 ). T20.6은시스테인 -매듭구조에의해서로고정된 4개의서열을함유하나, 루프 1 및 3의일부 (T19.2 부분 ) 는포함하지않고, 루프 2의대부분을포함하지않는다. T21-22는 T20과거의동일하나, 루프 2 영역에서 3개의아미노산을추가로갖는다. [0896] [0897] [0898] AspN 소화 AspN 소화물의 HPLC 크로마토그래피는수개의주피크를생성시켰다 ( 도 10B). 서열분석은 HPLC에의해회수되는펩티드피크에대해수행되었다. 펩티드소화물의온-라인 ESI LC-MS 분석은또한 HPLC에의해분리된펩티드의정확한질량을측정하여수행하였다. 이와같이, AspN 소화에의한펩티드피크내에존재하는펩티드를규명하였다 ( 도 12). 도 14는스클레로스틴서열에따른다양한펩티드서열 (AspN14.6, AspN18.6, AspN ) 의정렬을나타낸다. 각 AspN ( 예, AspN1 8.6) 에따른숫자는체류시간을반영한다. AspN14.6은스클레로스틴의 N- 및 C-말단아암둘다로부터의 3개의짧은펩티드를함유하는한편, AspN18.6은스클레로스틴의 N-말단아암으로부터의보다큰펩티드이다. AspN 은 104개아미노산의단일펩티드단편을함유하며, 8개의시스테인 (4개의디술피드결합 ) 모두, 시스틴-매듭, 및루프 1, 2 및 3 모두를포함한다. 에피토프를특징규명하기위한전략은각종트립신, 및 AspN 생성인간스클레로스틴펩티드를사용하여, 펩티드가각종항체 (Ab-A, Ab-B, Ab-C 및 Ab-D) 에여전히결합될수있는지의여부를결정하는것이다. 구체적으로이는비아코어 (Biacore)-기재 " 인간스클레로스틴펩티드에피토프경쟁결합검정 " 으로시험하였으며, 여기서 특정모노클로날항체의비아코어칩상에고정화된인간스클레로스틴으로의결합은각각의각종단리된트립신및 AspN HPLC 펩티드분획물유무로결정하였다. 임의의경쟁펩티드부재하에, 특정모노클로날항체는칩상에서인간스클레로스틴을결합시키며, 공명유닛 (RU) 반응을생성시킬수있다. 특정모노클로날항체를무손상인간스클레로스틴과함께용액중에서미리인큐베이션한다음칩과의결합을시험하여용액중에서 Mab 의인간스클레로스틴과의결합이 Mab가칩상의인간스클레로스틴과결합하는것을방지하므로이러한경쟁검정의일반적인원리가확인됨을입증하였다. [0899] [0900] [0901] [0902] 이러한일반적인절차를각펩티드에대해개별적으로반복하였다. 왕성한 RU 반응은시험한특정펩티드가용액중에서 Mab를결합시킬수없다는것을나타내는것으로받아들여졌다 ( 따라서, Mab는칩상에고정화된인간스클레로스틴을결합시키는데자유로움 ). 결론적으로, 왕성한 RU 반응의부재는 Mab가용액중에서스클레로스틴펩티드를결합시킬수있다는것을나타냈다. 이러한결합패턴, 즉다양한스클레로스틴펩티드의공지된동일물과의커플링은항-스클레로스틴항체 Ab-A, Ab-B, Ab-C 및 Ab-D에의해결합된스클레로스틴의에피토프를결정하는데사용하였다. 비아코어 -기재인간스클레로스틴펩티드에피토프경쟁결합검정인간스클레로스틴표면의제조 : 성숙형태인간스클레로스틴의비아코어센서칩 (CM5) 표면으로의고정화는제작자의지시서에따라 수행하였다. 요약하자면, 0.2 M N-에틸-N'-( 디메틸아미노프로필 ) 카르보디이미드 (EDC) 와 0.05 M N-히드록시숙신이미드 (NHS) 을함유한혼합물 60 μl를주사함으로써센서칩표면상의카르복실기를활성화시켰다. 10 mm 아세트산나트륨 (ph 4.0) 을사용하여인간스클레로스틴을 20 μg/ml의농도로희석한다음활성화된 CM5 표면상에주사하였다. 1 M 에탄올아민 60 μl를주사함으로써표면상의잉여량의반응기를불활성화시켰다. 최종고정화수준은인간스클레로스틴표면에대해약 5000 공명유닛 (RU) 이었다. 바탕의모방-커플링참조표면을센서칩상에또한제조하였다. [0903] [0904] 결합특이성분석 : 염화칼슘또는염화마그네슘무함유 1X 인산염완충식염수를미국캘리포니아주칼즈배드소재의기브코 / 인비트로겐 (Gibco/Invitrogen) 사로부터입수하였다. IgG-무함유소혈청알부민, 분획물 V를미국미주리주세인트루이스소재의시그마-알드리히 (Sigma-Aldrich) 사로부터입수하였다. 각 Mab (2 nm) 를샘플완충액 (1X PBS % P mg/ml BSA) 중에서 20 nm 인간스클레로스틴또는특정인간스클레로스틴펩티드 ( 주 :
94 AspN14.6 내에는 3개의연결되지않은펩티드가존재함 ) 와함께개별적으로인큐베이션한다음, 고정화된인간스클레로스틴표면상에주사하였다. 샘플주사유속은 5 μl/ 분이며, 이어서 8 mm 글리신 (ph 2.0) 중 1 M NaCl을 30초동안 30 μl/ 분으로사용하여표면을재생하였다. 비아평가 3.2를이용하여데이타를분석하고, 도 15 (Ab-A), 도 16 (Ab-B), 도 17 (Ab-C) 및도 18 (Ab-D) 에나타냈다. [0905] [0906] [0907] [0908] [0909] [0910] [0911] [0912] [0913] [0914] [0915] [0916] 루프 2 및 T20.6 에피토프 : 2종의대표항체 (Ab-A 및 Ab-B) 에대한스클레로스틴펩티드결합패턴은사실상동일하며 ( 도 15 및도 16), 이들항체둘다가오로지 AspN 펩티드를결합시킬수있음을나타냈다. AspN 와다른모든스클레로스틴펩티드간의유일한차이는 AspN 가무손상루프 2를함유한다는것이다. 이는 Ab-A 및 Ab-B가스클레로스틴의루프 2 영역에결합함으로써루프 2 에피토프를정의함을나타냈다 ( 도 19A). Ab-C 및 Ab-D에대한스클레로스틴펩티드결합패턴은서로간에사실상동일하나 ( 도 17 및도 18), Ab-A 및 Ab-B에대해발견한것과는완전히별개였다. 이들예에서시험된펩티드중에서, Ab-C 및 Ab-D가결합할수있는가장작은펩티드는 T20.6 펩티드였다. 이러한결과는 T20.6 에피토프를정의한다 ( 도 19B). 프로테아제보호검정 : 본검정의일반적인원리는 Mab가스클레로스틴에결합하는것이특정특이적프로테아제절단부위를보호할수있으며, Mab가결합하는스클레로스틴의영역을결정하는데상기정보를이용할수있다는것이다. "T20.6 유도체 1 ( 시스틴-매듭 + 4 아암 )" 에피토프 : 도 20은인간스클레로스틴 Ab-D 복합체 ( 도 2OA: 상기기재된바와같은트립신으로소화하기전에인간스클레로스틴을 Ab-D와함께 1:1 몰비율로미리인큐베이션함 ), 및인간스클레로스틴단독 ( 도 2OB: 인간스클레로스틴을상기기재된바와같은트립신으로소화시킴 ) 에대한 HPLC 펩티드맵을나타냈다. 도 20A의 T19.2 및 T20.6의펩티드피크는각피크높이가도 20B와비교하여명백하게감소되었음을나타났다. 피크높이의이러한감소는펩티드 T20 및 T21-22에대한피크높이의증가를수반하였다. 이러한데이타는, Ab-D의부재하에트립신에의해절단되어펩티드 T19.2 및 T20.6을생성시키는, 루프 1 및루프 3 내의염기성아미노산은 Ab- D가스클레로스틴에미리결합되는경우에트립신에의한절단에대해저항하였다. T20, T20.6 및 T21-22의존재는 Ab-D가스클레로스틴에미리결합되는경우에루프 2가여전히효율적으로절단됨을나타낸다. 이러한데이타는 Ab-D가 T20.6 에피토프의루프 1 및루프 3 상에결합됨으로써도 21에나타난바와같은보다작은 "T20.6 유도체 1 ( 시스틴-매듭 + 4 아암 )" 에피토프를정의한다는것을나타낸다. 실시예 5 마우스에서항-스클레로스틴모노클로날항체의생체내시험 4주령의 BDF1 수컷마우스를칼즈리버래보라토리즈 ( 미국노쓰캐롤라이나주롤리소재 ) 로부터입수하여각케이지에 5마리의동물을깨끗한케이지내에수용시켰다. 실온을 68 내지 72 로유지하고, 상대습도를 34 내지 73% 로유지하였다. 상기케이스를수용하는실험실은 12시간명암주기를가졌으며, 모든 AAALAC 사항을충족하였다. 연구에대한모든마우스의임상적관찰은 1일 1회수행하였다. 정제된항-스클레로스틴모노클로날항체 (Ab-A 도 1; Ab-B 도 2; Ab-C 도 3; Ab-D 도 4) 를멸균둘베코인산염완충식염수로희석하였다. 마우스에게체중 1 g 당 21 μl의항-스클레로스틴항체또는 PBS 비히클을매주 2 회씩 ( 월요일및목요일 ) 25 mg/kg으로피하주사하였다. 인간 PTH (1-34) 를 PTH 완충액 (0.001 N HCl, 0.15 M NaCl, 2% BSA) 로희석하여양성대조군으로서체중 1 g 당 21 μl를매주 5회씩 ( 월요일, 화요일, 수요일, 목요일, 금요일 ) 100 μg/kg으로피하투여하였다 ( 도 5 및 6). 집단당마우스의수는도 5 및 6에서는 N=5이고, 도 7에서는 N=6였다. PIXImus 생체내골밀도계골무기질밀도 (BMD) 는미국위스콘신주매디슨소재의지이 / 루나메디칼시스템즈 (GE/Lunar) 사의 PIXImus2 시스템을장착한말초이중에너지 X선흡수계측법 (peripheral Dual Energy X-ray Absorptometry; pdexa) 에의 해근위경골골간단및요추골에서매주측정하였다. 25 mm 2 의관심영역 (ROI) 은근위관절표면, 골단, 및경골의골간단상의근위말단을포함하여위치하였다. 관심영역 (ROI) 은요추골 (L1-L5) 을포함하여위치하였다. 근위경골및요부영역을분석하여총골무기질밀도를결정하였다. 집단평균은 ± 표준편차로기록되었으며, 통계분석을위해비히클처리군과비교하였다
95 [0917] [0918] [0919] [0920] [0921] [0922] [0923] 통계분석통계분석은던넷 (Dunnett) 및터키-크라머 (Tukey-Kramer) (BMD 데이타를위해 MS 엑셀및 JMP 버전 5.0. 을이용함 ) 를이용하여수행하였다. 각데이타세트에대한집단평균은 P 값이 0.05 (P < 0.05) 미만인경우에유의적으로상이한것으로간주하였다. 항체의스클레로스틴중화활성 Ab-A ( 도 5), Ab-B ( 도 5), Ab-C ( 도 6) 및 Ab-D의각각에대해나타낸비히클 ( 도 7) 에비해 BMD의통계적으로유의한증가는이들 4종의항체가스클레로스틴중화항체임을입증한다. 더욱이, 이러한데이타는, 마우스스클레로스틴과결합하는항-스클레로스틴항체의경우에상기한바와같이마우스의처리및분석을이용하여스클레로스틴중화항체를확인할수있다는것을나타냈다. 실시예 6 항체가인간스클레로스틴에결합하는것을차단하는항체에대한스크리닝검정표준아민커플링화학을이용하여 CM5 비아코어칩에인간스클레로스틴을커플링시켜스클레로스틴코팅된표면 을생성시켰다. 300 공명유닛의스클레로스틴을상기표면상에커플링시켰다. [0924] [0925] [0926] 시험할항체를 HBS-EP 완충액 (10 mm HEPES (ph 7.4), 150 mm NaCl, 3 mm EDTA, 0.005% (v/v) 계면활성제 P20 임 ) 중에 200 μg/ml의농도로희석하고, 이어서 1 대 1 몰비율 ( 결합부위를기준 ) 로혼합하여시험혼합물을생성시켰다. 이와같이, 시험혼합물은각항체를 100 μg/ml의농도 ( 결합부위를기준으로 1.3 μm) 로함유하였다. 시험믹스중에각항체를함유한분리용액단독을또한제조하였다. 상기용액은개별항체를 HBS- EP 완충액중에 100 μg/ml ( 결합부위를기준으로 1.3 μm) 으로함유하였다. 시험혼합물 200 μl를유속 10 μl/ 분으로스클레로스틴-코팅된칩을통과시키고, 결합양을기록하였다. 이어서, 30 mm HCl의 2회 60초펄스를이용하여상기칩을처리하여, 결합된항체를모두제거하였다. 이어서, 시험혼합물의항체중 1종만을함유한용액 ( 결합부위를기준으로, 시험혼합물로서동일한완충액중의 1.3 μm) 은시험혼합물로서동일한방식으로상기칩에통과시키고, 결합양을기록하였다. 상기칩을다시처리하여결합된항체를모두제거하였으며, 최종적으로시험혼합물단독으로부터다른항체를함유한용액 ( 결합부위를기준으로, 시험혼합물로서동일한완충액중의 1.3 μm) 을상기칩에통과시키고, 결합양을기록하였다. 하기표는상이한항체의범위에대해교차-차단검정에의한결과를나타냈다. 표의각셀내의값은, 표의상단열에나타낸항체 ( 결합부위를기준으로 1.3 μm) 또는완충액을표의제1 컬럼에나타낸항체 ( 결합부위를기준으로 1.3 μm) 또는완충액과혼합하는경우에나타난결합양 (RU) 을나타냈다. [0927] [0928] 상기표의항체의각조합에대한평균결합값 (RU) ( 각조합은 2 회씩수행하였기때문 ) 을이용하여, 항체의각 조합에의해나타난이론적결합비율을계산하는것이가능하다. 단독으로검정한경우에 ( 즉, 항체및완충 액 ), 각시험혼합물의성분에대한평균값의총합으로계산되는이론적인결합
96 [0929] [0930] [0931] [0932] [0933] [0934] [0935] [0936] [0937] [0938] 상기데이타로부터 Ab-4, Ab-A 및 Ab-19는서로교차-차단하는것이명백하였다. 유사하게, Ab-13 및 Ab-3는서로교차-차단하였다. 실시예 7 엘리자 (ELISA)-기반교차-차단검정본실시예에서사용한액체용량은 96-웰플레이트엘리자에전형적으로사용되는용량 ( 예, μl/ 웰 ) 일수있다. 본실시예에서 Ab-X 및 Ab-Y는, 약 145 Kd의분자량을가지고항체분자당 2 스클레로스틴결합부위를갖는것으로추정하였다. 항-스클레로스틴항체 (Ab-X) 를 1시간이상동안 96-웰엘리자플레이트 [ 예, 코닝 (Corning) 96 웰 EIA/RIA 평저마이크로플레이트 ( 제품번호 3590), 미국매사추세츠주액톤소재의코닝인크.(Corning Inc.)] 상에코팅하였다 ( 예, 1 μg/ml의 50 μ). 상기코팅단계후에, 항체용액을제거하고, 상기플레이트를세척용액 ( 예, PBS 및 0.05% 트윈 20) 으로 1회또는 2회세척하고, 이어서적절한차단용액 ( 예, PBS, 1% BSA, 1% 염소혈청및 0.5% 트윈 20) 을사용하고당업계에공지된절차를이용하여차단하였다. 이어서, 차단용액을엘리자플레이트로부터제거하고, 코팅된항체를교차-차단할수있는시험할제2의항-스클레로스틴항체 (Ab-Y) 를차단용액중과량으로 ( 예, 10 μg/ml의 50 μl) 엘리자플레이트의적절한웰에첨가하였다. 상기를수행한후에이어서차단용량중스클레로스틴의한정량 ( 예, 10 ng/ml의 50 μl) 을적절한웰에첨가하고, 상기플레이트를교반하면서실온에서 1시간동안인큐베이션하였다. 이어서, 상기플레이트를세척용액으로 2회내지 4회세척하였다. 차단용액중적정량의스클레로스틴검출시약 [ 예, 적정량의스트렙타비딘-호스래디쉬퍼옥시다제 (HRP) 접합체와미리-결합된비오틴화항-스클레로스틴폴리클로날항체 ] 을엘리자플레이트에첨가하고, 실온에서 1시간이상동안인큐베이션하였다. 이어서, 상기플레이트를 4회이상세척용액으로세척하고, 적절한시약 [ 예, HRP 기질, 예컨대 TMB ( 비색성 ) 또는다양한 HRP 발광기질 ] 으로발색시켰다. 검정에대한배경신호는코팅된항체 ( 이경우 Ab-X), 제2 용액상항체 ( 이경우 Ab-Y), 오로지스클레로스틴완충액 ( 즉, 스클레로스틴무함유 ) 및스클레로스틴검출시약을사용하여웰중에서수득한신호로정의한다. 검정에대한양성대조군신호는코팅된항체 ( 이경우 Ab-X), 오로지제2 용액상항체완충액 ( 즉, 제2 용액상항체무함유 ), 스클레로스틴및스클레로스틴검출시약을사용하여웰중에서수득한신호로정의한다. 엘리자검정은 6회이상의배경신호를양성대조군신호가되게하는방식으로실행할필요가있다. 코팅된항체로서사용하기위한항체및제2 ( 경쟁 ) 항체로서사용하기위한항체의선택으로부터야기되는임의의인공물 ( 스클레로스틴에대한 Ab-X와 Ab-Y 간의유효적으로상이한친화도 ) 을피하기위해, 교차-차단검정은하기의 2가지형식으로실행할필요가있다 : 1) 형식 1은 Ab-X가엘리자플레이트상에코팅된항체이고, Ab-Y가용액중에존재하는경쟁항체인것이고, 2) 형식 2는 Ab-Y가엘리자플레이트상에코팅된항체이고, Ab-X가용액중에존재하는경쟁항체인것이다. Ab-X 및 Ab-Y는, 형식 1 또는형식 2의경우에, 용액상항-스클레로스틴항체가용액상항-스클레로스틴항체의부재하에수득된스클레로스틴검출신호 ( 즉, 양성대조군웰 ) 와비교하여스클레로스틴검출신호 ( 즉, 코팅된항체에의해결합된스클레로스틴의양 ) 가 60% 내지 100%, 특히 70% 내지 100%, 보다특히 80% 내지 100% 감소될수있는지에따라교차-차단으로정의한다. 스클레로스틴의태깅 (tagging) 버전, 예컨대 N-말단 His-태깅된스클레로스틴 ( 미국매사추세츠주미니애폴리스소재의알앤드디시스템즈 (R&D Systems); 2005 카탈로그번호 1406-ST-025) 을엘리자에사용하는경우에, 적절한유형의스클레로스틴검출시약은 HRP-표지된항-His 항체를포함할수있다. N-말단 His-태깅된스클레로스틴사용에더하여, 또한 C-말단 His-태깅된스클레로스틴을사용할수있다. 더욱이, 당업계에공지된각
97 종다른태그및태그결합단백질조합물 ( 예, 항 -HA 항체와의 HA 태그 ; 항 -FLAG 항체와의 FLAG 태그 ; 스트렙 타비딘과의비오틴태그 ) 을상기엘리자 - 기반교차 - 차단검정에사용할수있다. [0939] [0940] [0941] [0942] [0943] [0944] [0945] [0946] [0947] [0948] 실시예 8 스클레로스틴활성을길항할수있는확인용작용제에대한세포기반무기질침착검정도입부배양중조골세포계세포, 즉 1차세포또는세포주에의한무기질침착은골형성의시험관내모델로서사용한다. 무기질침착은 1종이상의분화작용제에의한조골세포계세포분화의유도를개시시키는데약 1주내지 6 주가걸린다. 전반적인연속사건은세포증식, 분화, 세포외매트릭스생성, 매트릭스성숙, 및최종적으로무기질침착 ( 이는인산칼슘의결정화및 / 또는침착을의미함 ) 을포함한다. 세포증식및분화로시작하여무기질침착으로끝나는이러한연속사건은본원에서무기질침착으로나타낸다. 칼슘 ( 무기질 ) 의측정은검정의결과이다. 무기질의침착은강력한생물리학적특징을가지며, 즉무기질 " 시드 " 가형성되기시작하면전체배양중침착될것인무기질의총량이이후에수일내에매우급속히침착될수있다. 배양중무기질침착의시기및정도는부분적으로사용할특정조골세포계세포 / 세포주, 성장조건, 분화작용제의선택, 및세포배양배지에사용되는혈청의특정제품번호에의해영향을받는다. 조골세포계세포 / 세포주무기질침착배양에대해, 하나이상의공급사로부터의적어도 8개내지 15개의혈청제품은무기질침착이발생하는특정혈청제품을확인하기위해시험되어야한다. MC3T3-E1 세포 ( 문헌 [Sudo H et al, In vitro differentiation and calcification in a new clonal osteogenic cell line derived from newborn mouse calvaria. J. Cell Biol. 96: ]) 및원세포주의서브클론은분화작용제의존재하에성장시배양중에무기질을형성할수있다. 상기서브클론은 MC3T3-E1-BF ( 문헌 [Smith E, Redman R, Logg C, Coetzee G, Kasahara N, Frenkel B Glucocorticoids inhibit developmental stage-specific osteoblast cell cycle. J Biol Chem 275: ]) 를포함한다. 스클레로스틴중화항체의확인 MC3T3-E1-BF 세포를무기질침착검정에사용하였다. 아스코르브산및 B-글리세로포스페이트를사용하여무기질침착을발생시키는 MC3T3-E1-BF 세포분화를유도하였다. 특정스크리닝프로토콜은, 96-웰형식으로수요일에세포를플레이팅한다음, 대부분의무기질침착이발생하는마지막대략 8시간 ( 예를들어, 일요일밤부터월요일까지 ) 을포함한 12일기간에걸쳐배지를 7회교체하였다 ( 하기에추가로기재된바와같음 ). 임의의주어진처리에대해, 3개의웰을사용하였다 (N=3). 무기질침착의특정시기및정도는부분적으로사용할특정혈청제품번호에따라다를수있다. 대조군시험은, 일반적으로세포배양시험에대해당업계에익히공지된바와같이, 상기변수에의해설명될것이다. 상기검정시스템에서, 스클레로스틴은, 무기질침착을발생시켜이를포함하는하나이상의연속사건을억제하였다 ( 즉, 스클레로스틴은무기질침착을억제함 ). 스클레로스틴의억제활성을중화시킬수있는항-스클레로스틴항체는스클레로스틴의존재하에배양의무기질침착을허용함으로써, 오로지스클레로스틴처리군 ( 즉, 항체무함유 ) 에서측정된칼슘의양에비해인산칼슘의침착 ( 칼슘에대해측정 ) 은통계상유의적으로증가하였다. 통계분석 (MS 엑셀및 JMP 이용 ) 에대해, 일원식-아노바 (ANOVA) 에이어던넷비교를이용하여집단간의차이를결정하였다. 각데이타세트에대한집단평균은 P 값이 0.05 미만인경우에 (P < 0.05) 유의적으로상이한것으로간주하였다. 상기검정을실행에의한대표적인결과는도 22에나타냈다. 재조합마우스스클레로스틴의부재하에, 무기질침착을발생시켜이를포함하는연속사건을통상적으로진행하였다. 각처리군에서칼슘수준은평균 ± 평균의표준오차 (SEM) 로나타냈다. 상기예시실험에서, 칼슘검정에의한칼슘수준은약 31 μg/ml였다. 그러나, 재조합마우스스클레로스틴을첨가하자무기질침착이억제되었으며, 칼슘은약 85% 까지감소되었다. 항-스클레로스틴모노클로날항체 Ab-19 또는 Ab-4를재조합스클레로스틴과함께첨가하자, 스클레로스틴의억제활성이하나의항체에의해중화되기때문에오로지스클레로스틴-처리군에비해무기질침착이통계상유의적으로증가하였다. 상기실험에의한결과는 Ab-19 및 Ab-4가스클레로스틴중화모노클로날항체 (Mab) 임을나타냈다. 도 23은재조합인간스클레로스틴및 2종의인간화항-스클레로스틴 Mab를이용하여매우유사한결과를나타냈다. 도 24는나타낸바와같은재조합인간스클레로스틴및마우스및인간화항-스클레로스틴 Mab를이용
98 하여매우유사한결과는나타냈다. [0949] [0950] 도 22, 23 및 24 에나타난실험에사용된항체는분자량이약 145 Kd 이고, 항체분자당 2 곳의스클레로스틴결 합부위를가졌다. 자세한 MC3T3-E1-BF 세포배양프로토콜은하기에기재하였다. [0951] 표 3 시약및배지 시약 회사 카탈로그번호 알파-MEM 기브코-인비트로겐 아스코르브산 시그마 A4544 베타-글리세로포스페이트 시그마 G6376 1OOX 펜스트렙글루타민 기브코-인비트로겐 (PenStrepGlutamine) 디메틸술폭시드 (DMSO) 시그마 D5879 또는 D2650 소태아혈청 (FBS) 칸세라 (Cansera) CS-C 또는소태아혈청 (FBS) 테라셀인터내셜날 (TerraCell Int.) ( 제품번호 SF50310) CS-C A ( 제품번호 SF-20308) [0952] [0953] [0954] [0955] [0956] 알파-MEM은통상적으로 1년만기일을갖도록제조되었다. 제조일이후 6개월이상경과되지않은알파-MEM을세포배양에사용하였다. 증식배지 ( 알파-MEM/10%FBS/ 펜스트렙글루 ) 를하기와같이제조하였다 : 500 ml 병의 FBS를해동시키고, 0.22 마이크로미터필터를통과시켜필터멸균시켰다. 상기 FBS 100 ml를알파 -MEM 1 l에첨가한다음 10Ox 펜스트렙글루타민 100 ml를첨가하였다. 사용하지않은 FBS를분취하여후에사용하도록냉동시켰다. 분화배지 ( 알파-MEM/10%FBS/ 펜스트렙글루, + 50 μg/ml 아스코르브산, + 10 mm 베타-글리세로포스페이트 ) 를하기와같이제조하였다 : 하기와같이아스코르브산및베타-글리세로포스페이트를함유한증식배지 100 ml를보충함으로써분화배지 100 ml를제조하였다 : [0957] 원액농도 표 4 용량 ( 하기참조 ) 아스코르브산 10 mg/ml 0.5 ml 100 μg/ml 최종농도 (50 μg/ml + 50 μg/ml) β-글리세로포스페이트 1 M 1.0 ml 1O mm [0958] [0959] [0960] 분화배지를세포배양에사용하는날에단지증식배지를보충함으로써분화배지를제조하였다. 알파-MEM이이미 50 μg/ml 아스코르브산을함유했기때문에분화배지내아스코르브산의최종농도는 100 μg/ml였다. 아스코르브산원액 (10 mg/ml) 을제조하고, -8O 에서냉동시키기위해분취하였다. 각분취액을한번에사용하였다 ( 즉, 재냉동시키지않음 ). 베타-글리세로포스페이트원액 (1 M) 을제조하고, -2O 에서냉동시키기위해분취하였다. 각분취액을냉동시키고, 최대 5회까지해동시킨다음버렸다. MC3T3-E1-BF 세포의증식을위한세포배양세포를 37 및 5% CO 2 에서배양하였다. 스클레로스틴중화항체에대해스크리닝목적을위해세포은행을 발생시켰다. 세포은행을하기와같이생성시켰다 : [0961] 냉동 MC3T3-E1-BF 세포 1 바이알을 37 수조중에서교반하여해동시켰다. 해동세포를 50 ml 의튜브내증 식배지 ( 알파 -MEM/10%FBS/ 펜스트렙글루 ) 10 ml 에넣고, 5 분동안완만하게스핀다운시켰다. 이어서, 세포를
99 알파 -MEM/10%FBS/ 펜스트렙글루 4 ml 중에재현탁시켰다. 트립판블루및혈구계를이용하여세포수를측정한 후에, 알파 -MEM/10%FBS/ 펜스트렙글루배지 50 ml 중 1 x 10 6 개세포를하나의 T175 플라스크내에플레이팅하였 다. [0962] 이들계대가전면성장한경우에 ( 대략제 7 일째 ), 세포를트립신 /EDTA (0.05% 트립신 ; 0.53 mm EDTA) 으로트립신 처리하고, 5 분동안완만하게스핀다운시키고, 이어서알파 -MEM/10%FBS/ 펜스트렙글루 5 ml 중에재현탁시켰다. 트립판블루및혈구계를이용하여세포수를측정한후에, 1 개의 T175 플라스크당알파 -MEM/10%FBS/ 펜스트렙 글루배지 50 ml 중 1 x 10 6 개세포를플레이팅하였다. 상기시점에서플레이팅에사용된 T175 플라스크의수 는이용가능한전체세포수및다음계대에서취하게되는플라스크의원하는수에따라다르다. 잉여량의세 포를 90%FBS/10%DMSO 1 ml 당 1 내지 2 x 10 6 개살아있는세포로냉동시켰다. [0963] 본계대가전면성장한경우에 ( 약 3 내지 4 일 ), 세포를트립신 /EDTA (0.05% 트립신 ; 0.53 mm EDTA) 로트립신처 리하고, 5 분동안완만하게스핀다운시키고, 이어서알파 -MEM/10%FBS/ 펜스트렙글루 5 ml 중에재현탁시켰다. 트립판블루및혈구계를이용하여세포수를측정한후에, 1 개의 T175 플라스크당알파 -MEM/10%FBS/ 펜스트렙 글루배지 50 ml 중 1 x 10 6 개세포를플레이팅하였다. 상기시점에서플레이팅에사용된 T175 플라스크의수 는이용가능한전체세포수및다음계대에서취하게되는플라스크의원하는수에따라다르다. 잉여량의세 포를 90%FBS/10%DMSO 1 ml 당 1 내지 2 x 10 6 개살아있는세포로냉동시켰다. [0964] 본계대가전면성장한경우에 ( 약 3 내지 4 일 ), 세포를트립신 /EDTA (0.05% 트립신 ; 0.53 mm EDTA) 로트립신처 리하고, 5 분동안완만하게스핀다운시키고, 이어서알파 -MEM/10%FBS/ 펜스트렙글루 5 ml 중에재현탁시켰다. 트립판블루및혈구계를이용하여세포수를측정한후에, 1 개의 T175 플라스크당알파 -MEM/10%FBS/ 펜스트렙 글루배지 50 ml 중 1 x 10 6 개세포를플레이팅하였다. 상기시점에서플레이팅에사용된 T175 플라스크의수 는이용가능한전체세포수및다음계대에서취하게되는플라스크의원하는수에따라다르다. 잉여량의세 포를 90%FBS/10%DMSO 1 ml 당 1 내지 2 x 10 6 개살아있는세포로냉동시켰다. [0965] 본계대가전면성장한경우에 ( 약 3 내지 4 일 ), 세포를트립신 /EDTA (0.05% 트립신 ; 0.53 mm EDTA) 로트립신처 리하고, 5 분동안완만하게스핀다운시키고, 이어서알파 -MEM/10%FBS/ 펜스트렙글루 5 ml 중에재현탁시켰다. 트립판블루및혈구계를이용하여세포수를측정한후에, 세포를 90%FBS/10%DMSO 1 ml 당 1 내지 2 x 10 6 개 살아있는세포로냉동시켰다. 냉동세포의이러한 " 최종계대 " 는스크리닝검정에사용하는계대였다. [0966] [0967] MC3T3-E1-BF 세포를무기질침착시키기위한세포배양 세포를 37 및 5% CO2 에서배양하였다. 무기질침착세포배양절차동안온도및 % CO 2 변동을최소하는것 이바람직하다. 이는영양공급동안플레이트를인큐베이터밖에두는시간을최소화함으로써및또한무기질침착세포배양절차동안인큐베이터문의개폐횟수를최소화함으로써달성할수있다. 이와관련하여, 무기질침착세포배양만하도록조직배양인큐베이터를갖추는것 ( 및따라서필요한경우에만개폐함 ) 이유용할수있다. [0968] [0969] [0970] [0971] 상기한바와같이제조된 " 최종계대 " 바이알의적절한수를 37 수조내에서교반하여해동시켰다. 해동세포를 50 ml의튜브내증식배지 ( 알파-MEM/10%FBS/ 펜스트렙글루 ) 10 ml에넣고, 5분동안완만하게스핀다운시켰다. 이어서, 세포를알파-MEM/10%FBS/ 펜스트렙글루 4 ml 중에재현탁시켰다. 트립판블루및혈구계를이용하여세포수를측정한후에, 콜라겐 I 코팅된 96-웰플레이트 ( 벡톤디킨슨랩웨어 (Becton Dickinson Labware), 카탈로그번호 ) 상에웰당증식배지 200 μl 중 2500개세포를플레이팅하였다. 무기질침착플레이트-가장자리효과를피하기위해, 플레이트주위의모든곳의가장바깥쪽열 / 컬럼에는세포를플레이팅하지않았다. 대신에 PBS 200 μl를상기웰에첨가하였다. 예시적인세포배양절차하기절차에서, 세포플레이팅출발일은수요일로지정하였다. 그주의다른날을세포플레이팅출발일로지정하는경우에, 하기에나타낸바와같이전체과정동안배지제거및첨가에대한 1일스케줄을생성해야할것이다. 예를들어, 세포를화요일에플레이팅한경우에, 배지는제1 금요일및토요일또는제2 금요일및토요일둘다에서제거하고추가하지않아야한다. 화요일에개시된경우에, 플레이트는최종일요일에칼슘검정
100 을위해제조될수있다. [0972] [0973] [0974] [0975] [0976] [0977] [0978] [0979] [0980] [0981] [0982] [0983] [0984] [0985] 세포를수요일에증식배지 200 μl 중 2500개세포로플레이팅하였다. 목요일에, 증식배지전부를제거하고, 분화배지 200 μl를첨가하였다. 금요일에, 배지 100 μl를제거하고, 새로운분화배지 100 μl를첨가하였다. 월요일에, 배지 100 μl를제거하고, 새로운분화배지 100 μl를첨가하였다. 화요일에, 배지 100 μl를제거하고, 새로운분화배지 100 μl를첨가하였다. 수요일에, 배지 100 μl를제거하고, 새로운분화배지 100 μl를첨가하였다. 목요일에, 배지 100 μl를제거하고, 새로운분화배지 100 μl를첨가하였다. 금요일에, 배지 100 μl를제거하고, 새로운분화배지 100 μl를첨가하였다. 그다음월요일에, 칼슘검정을위해하기와같이플레이트를제조하였다 : 플레이트를 10 mm 트리스, HCl (ph 7-8) 로 1회세척하였다. 흄후드하에서작업한후에, 웰당 0.5 N HCl 200 μl를첨가하였다. 이어서, 플레이트를 -8O 에서냉동시켰다. 칼슘을측정하기바로직전에, 플레이트를 2회냉동-해동시키고, 이어서분쇄하고, 다중채널피펫을사용하여플레이트함유물을분배시켰다. 이어서, 플레이트함유물을 4 에서 30분동안정치시키고, 그시점에서상업적으로이용가능한칼슘키트를이용하여칼슘을측정하기위해적정량의상등액을분리하였다. 예시적비제한적인키트는칼슘 (CPC) 리퀴컬러 (Liquicolor) [ 미국텍사스주보에른소재의스탄비오래보라토리즈 (Stanbio Laboratory) 의카탈로그번호 ] 였다. 상기세포기반검정에서, 스클레로스틴은, 무기질침작을발생시키고이를포함하는하나이상의연속사건을억제하였다 ( 즉, 스클레로스틴은무기질침착을억제함 ). 따라서, 특정세포배양실험에스클레로스틴을포함하는실험에서, 제1 목요일에시작하여이후매일공급일에재조합스클레로스틴을배지에첨가하였다. 스클레로스틴을중화시키는능력에대해항-스클레로스틴모노클로날항체 (Mab) 를시험하는경우, 즉무기질침착을억제하는스클레로스틴의능력을중화시킴으로써무기질침착을허용하는경우에, 제1 목요일에시작하여이후매일공급일에 Mab를배지에첨가하였다. 프로토콜에따라, 이를하기와같이달성하였다 : Mab를분화배지중에서재조합스클레로스틴과함께 37 에서 45 내지 60분동안미리인큐베이션하고, 이어서세포에영양공급을위해상기배지를사용하였다. MC3T3-E1-BF 세포에대한제12일무기질침착프로토콜은상기와같이기재되었다. 동일한시약및영양공급프로토콜을이용하여, 본발명자들이 RIKEN 세포은행 ( 일본 이바라끼쯔꾸바시 RIKEN 바이오리소스센터 꼬야다이알씨비 1126) 으로부터입수한원 MC3T3-E1 세포 ( 문헌 [Sudo H, Kodama H-A, Amagai Y, Yamamoto S, Kasai S In vitro differentiation and calcification in a new clonal osteogenic cell line derived from newborn mouse calvaria. J Cell Biol 96: ]) 를무기질침착시키는데 MC3T3-E1-BF 세포보다더오래 ( 무기질침착에대해총 20일 ) 걸렸다. 원 MC3T3-E1 세포의무기질침착은재조합스클레로스틴에의해억제되었으며, 이러한억제는스클레로스틴중화항체를사용하여차단하였다. 실시예 9 [0986] [0987] SCID 마우스에서결장염의 CD4 CD45RB HI 모델개관 전달모델에서염증 - 유도된골손실로부터의항 - 스클레로스틴항체보호 [0988] CD4+ T 세포의 CD45RB 높음아집단을 C.B-17 scid 마우스로주사하면인간염증성장질환 (IBD) 의특징과유사한특징을갖는만성장염증을일으킨다. 상피세포과다형성및육아종형성을수반한결장으로중증백혈구침윤을갖는세포를전달한후에설사및소모병을 3 내지 5주동안주목하였다. CD4+ 세포의상호아집단을투 여한 C-B-17 scid 마우스, 즉 CD45RB 낮음을발현하는마우스는결장염을나타내지않으며, 주사되지않은 scid 마우스와구별되지않게체중이증가하였다. 결장염증상에더하여, 결장염의 CD4+ CD45RB 높음 T 세포전달모델은, 식이흡수장애이외의염증메카니즘을주로통할것으로고려되는 ( 문헌 [Byrne, F. R. et al., Gut 54:78-86, 2005]) 골무기질밀도 (BMD) 의감소를수반하였다
101 [0989] [0990] 결장염유도및염증 - 유도된골손실 비장을암컷 balb/c 마우스로부터취하고, 70 μm 세포여과기를통해분쇄하였다. 이어서, B220, MAC-1, CD8 및 I-A d 에대한항체를이용하는디나비드 (Dynabead) 로음성선별에의해 CD4+ 집단을풍부하게하였다. 이어서, 풍부집단은 FITC 접합된항-CD4 및 PE 접합된항-CD45RB로염색되었으며, 모플로 (Moflo; 다코시토메이션 (Dakocytomation)) 상에서 2색분류함으로써 CD4+CD45RB 높음및 CD4+CD45RB 낮음집단으로분별하였다. CD45RB 높음및 CD45RB 낮음집단은 CD4+ 세포의각각가장밝은염색 40% 및가장흐릿한염색 20% 로정의하였다. 이어서, 5 x 10 5 개세포를제0일에 C.B-17 scid 마우스로복막내주사하고, 묽은변또는설사및체중감소를통해결장염의진행을모니터링하였다. 골무기질밀도측정은연구종료시 ( 제88일 ) 에수행하였다. [0991] [0992] 결장염증상및 BMD에대한항-스클레로스틴처리의효과 CD4+CD45RB 높음세포전달전날부터 Ab-A IgG를 10 mg/kg으로피하투여하고, 또한음성대조군항체 101.4를 10 mg/kg으로피하투여한마우스와비교하였다. 이후에상기항체를매주투여하였다. 비-병원성 CD4+CD45RB 낮음세포를투여하고 10 mg/kg 를투여한마우스집단은대조군으로서연구하였다. 연구종료시 ( 제 88 일 ), 골무기질밀도를측정하고, 세포침윤의분석및조직손상의평가를위해결장절편을취하였다. [0993] [0994] [0995] [0996] a) 결장염증상의효과없음전형적인결장염증상, 체중감소및염증세포의결장으로의침윤은 Ab-A로처리한경우에어떠한영향도받지않았다. 유사하게, Ab-A 처리이후결장에대한조직손상이개선되지않았다. b) 골무기질밀도의염증-유도된손실억제세포를 C.B-17 scid 마우스로전달한후제88일에, 골무기질밀도를측정하였다 ( 총 BMD, 척추골 BMD 및대퇴 골 BMD). CD4+CD45RB 낮음비-병원성세포를투여한대조군마우스와비교하여, CD4+ CD45RB 높음 T 세포및음성대조군항체 101.4를투여한마우스는도 25에서나타낸바와같이골무기질밀도가감소되었다. 반대로, Ab- A 처리이후에 BMD의감소는나타나지않았다. 전체, 척추골및대퇴골의 BMD 측정값은 CD4+ CD45RB 높음 T 세포를투여하고 Ab-A로처리한마우스에서 CD4+ CD45RB 높음 T 세포를투여하고 101.4로처리한마우스보다유의적으로높았다 ( 본페로니 (Bonferroni) 다중비교검정에의해 P<0.001). [0997] [0998] 실시예 10 인간스클레로스틴에대한항 - 스클레로스틴항체친화도 (K D ) 의킨엑사 (KinExA)- 기반측정 [0999] 킨엑사 (KinExA ) 3000 ( 미국아이다호주보이시소재의사피다인인스트러먼츠인크.(Sapidyne Instruments Inc.)) 을이용하여인간스클레로스틴에대한몇가지항-스클레로스틴항체의친화도를용액평형결합분석에의해평가하였다. 이러한측정을위해, 리액티 (Reacti)-겔 6x 비드 ( 미국일리노이주록포드소재의피어스 (Pierce)) 를 50 mm Na 2 CO 3 (ph 9.6) 중 40 μg/ml 인간스클레로스틴으로 4 에서밤새예비코팅하였다. 이어 서, 비드를 1 M 트리스-HCl (ph 7.5) 중 1 mg/ml BSA로 4 에서 2시간동안차단하였다. 10 pm, 30 pm 또는 100 pm의항체를 0.1 pm 내지 1 nm의농도에이르는다양한농도의인간스클레로스틴과혼합하고, 0.1 mg/ml BSA 및 0.005% P20을함유한 PBS 중실온에서 8시간초과동안평형을이루게하였다. 이어서, 혼합물을인간스클레로스틴코팅된비드에통과시켰다. 마우스또는인간항체샘플각각에대해형광 Cy5-표지된염소항- 마우스-IgG 또는형광 Cy5-표지된염소항-인간-IgG 항체 ( 미국펜실바니아주웨스트그로브소재의잭슨이뮤노리서치 (Jackson Immuno Research)) 을사용하여비드-결합된항-스클레로스틴항체의양을정량하였다. 측정된형광신호의양은평형을이룬각반응혼합물에서유리항-스클레로스틴항체의농도에비례하였다. 킨엑사프로 (KinExA Pro) 소프트웨어에서제공되는 n-곡선한자리균일결합모델 (n-curve one-site homogeneous binding model) 을이용하여경쟁곡선의비선형회귀로부터해리평형상수 (K D ) 를얻었다. 선택된항체에대한킨엑사검정의결과를하기표에요약하였다
102 표 5 [1000] 항체항원 KD (pm) 95% 신뢰구간 Ab-13 인간스클레로스틴 pm Ab-4 인간스클레로스틴 pm Ab-19 인간스클레로스틴 pm Ab-14 인간스클레로스틴 pm Ab-5 인간스클레로스틴 pm Ab-23 인간스클레로스틴 pm [1001] [1002] [1003] 실시예 11 인간스클레로스틴에대한인간화항 - 스클레로스틴항체의친화도를측정하는비아코어방법 비아코어기술은표지하지않고생분자간결합을실시간으로모니터링한다. 리간드라불리는상호반응물중하나 를고정화된표면상에직접고정화하거나포획하는한편, 분석물이라하는다른하나는포획된표면을통해용액으로유동시켰다. 센서는분석물이리간드와결합하여표면상에서복합체를형성할때센서표면상에서의질량변화를검출한다. 이는해리과정에상응한다, 해리과정은분석물이완충액으로대체되는경우에모니터링하였다. 친화도비아코어검정에서, 리간드는항-스클레로스틴항체이고, 분석물은스클레로스틴이었다. [1004] [1005] [1006] [1007] [1008] [1009] 기구비아코어 3000, 비아코어 AB, 스웨덴업살라소재센서칩 CM5 ( 연구등급 ) 카탈로그번호 : BR , 비아코어 AB, 스웨덴업살라소재. 칩은 4 에저장함. 비아중화용액 70% (w/w) 글리세롤. 비아유지키트카탈로그번호의일부 : BR , 비아코어 AB, 스웨덴업살라소재. 비아 유지키트는 4 에저장함. [1010] [1011] [1012] [1013] [1014] [1015] [1016] 아민커플링키트카탈로그번호 : BR Q, 비아코어 AB, 스웨덴업살라소재. 에틸-3-(3-디메틸아미노프로필 ) 카르보디이미드히드로클로라이드 (EDC). 증류수중에 75 mg/ml이되게하여 200 μl의분취액으로 -70 에저장함. N-히드록시숙신이미드 (NHS). 증류수중에 11.5 mg/ml이되게하여 200 μl의분취액으로 -70 에저장함. 1 M 에탄올아민히드로클로라이드-NaOH (ph 8.5). 200 μl의분취액으로 -70 에저장함. 완충액포획항체를고정화시키기위한작업완충액 : HBS-EP (0.01 M HEPES (ph 7.4), 0.15 M NaCl, 3 mm EDTA, 0.005% 계면활성제 P20임 ). 카탈로그번호 : BR , 비아코어 AB, 스웨덴업살라소재. 완충액은 4 에 저장함. [1017] 고정화완충액 : 아세테이트 5.0 (10 mm 아세트산나트륨 (ph 5.0) 임 ). 카탈로그번호 : BR , 비아코어 AB, 스웨덴업살라소재. 완충액은 4 에저장함. [1018] [1019] 결합검정을위한작업완충액 : CM-덱스트란 ( 카탈로그번호 27560, 스위스부흐스소재의플루카바이오케미카 (Fluka BioChemika)) 을 1 mg/ml로첨가한 HBS-EP (0.01 M HEPES (ph 7.4), 0.15 M NaCl, 3 mm EDTA, % 계면활성제 P20, 카탈로그번호 : BR , 비아코어 AB, 스웨덴업살라소재임 ). 완충액은 4 에저장함. 리간드포획
103 [1020] 어피니퓨어 (Affinipure) F(ab') 2 단편염소항 - 인간 IgG, Fc 단편특이성. 잭슨이뮤노리서치인크. ( 미국펜 실바니아주소재 ) 카탈로그번호 : 완충액은 4 에저장함. [1021] [1022] [1023] [1024] [1025] [1026] [1027] 리간드인간화항-인간스클레로스틴항체 Ab5, Ab14 및 Ab20. 분석물재조합인간스클레로스틴. 분취액은 -7O 에저장하고, 각검정을위해 1회해동함. 재생용액 11.6 M 원액 ( 영국풀레소재의 BDH, 카탈로그번호 : H) 으로부터증류수로희석하여제조된 40 mm HCl. 50 mm 원액으로부터증류수로희석하여제조된 5 mm NaOH. 카탈로그번호 : BR , 비아코어 AB, 스웨덴업 살라소재. [1028] [1029] [1030] [1031] 검정방법검정형식은고정화된항-인간 IgG-Fc에의한항-스클레로스틴항체의포획에이어서포획된표면에대한스클레로스틴의적정임. 절차의예시는하기에나타냈다 : BIA ( 비아분자상호작용분석 ) 는비아코어 3000 ( 비아코어 AB) 을이용하여수행하였다. 어피니퓨어 F(ab') 2 단편염 소항-인간 IgG, Fc 단편특이성 ( 잭슨이뮤노리서치 ) 은아민커플링화학을통해 CM5 센서칩상에포획수준약 4000 반응유닛 (RU) 으로고정화되었다. 1 mg/ml CM-덱스트란을함유한 HBS-EP 완충액 (10 mm HEPES (ph 7.4), 0.15 M NaCl, 3 mm EPTA, % 계면활성제 P20, 비아코어 AB) 을작업완충액으로서유속 10 μl/ 분으로사용하였다. 약 5 μg/ml의항-스클레로스틴항체 10 μl를주사하여고정화된항-인간 IgG-Fc에의한포획에사용하였다. 항체포획수준은전형적으로 RU였다. 스클레로스틴을포획된항-스클레로스틴항체에대해 30 μl/ 분의유속으로다양한농도로적정하였다. 유속 10 μl/ 분으로 40 mm HCl를 2회 10 μl 주사하고이어서 5 mm NaOH를 5 μl를주사함으로써상기표면을재생하였다. [1032] 배경공제결합곡선은표준절차에따라비아평가소프트웨어 ( 버전 3.2) 를이용하여분석하였다. 역학파라미 터는교정알고리즘으로부터결정하였다. [1033] [1034] 역학데이타및계산한해리상수는표 2 에나타냈다. < 표 2> [1035] [1036] [1037] [1038] [1039] [1040] 실시예 12 시노몰구스 (CYNOMOLGUS) 원숭이에서항-스클레로스틴모노클로날항체의생체내검정 33마리의약 3 내지 5년령의암컷시노몰구스원숭이 ( 막트카파시쿨라리스 (Macctca fascicularis)) 를상기 2개월간연구에사용하였다. 본연구는 11 집단을포함한다 : 집단 1 : 비히클 (N=4) 집단 2: Ab-23 (N=2, 투여량 3 mg/kg)
104 [1041] [1042] [1043] [1044] [1045] [1046] [1047] [1048] [1049] [1050] [1051] [1052] [1053] [1054] [1055] [1056] 집단 3: Ab-23 (N=3, 투여량 10 mg/kg) 집단 4: Ab-23 (N=3, 투여량 30 mg/kg) 집단 5: Ab-5 (N=3, 투여량 3 mg/kg) 집단 6: Ab-5 (N=3, 투여량 10 mg/kg) 집단 7: Ab-5 (N=3, 투여량 30 mg/kg) 집단 8: Ab-14 (N=3, 투여량 3 mg/kg) 집단 9: Ab-14 (N=3, 투여량 10 mg/kg) 집단 10: Ab-14 (N=3, 투여량 30 mg/kg) 집단 11: 부갑상선호르몬 (1-34) [PTH (1-34)] (N=3, 투여량 10 μg/kg) 모든투여는피하투여였다. PTH (1-34) 를매일투여하고, 모노클로날항체 (Mab) 를 2회투여하였다 ( 연구개시시점에제1 투여및 1개월시점에제2 투여 ). 골파라미터 ( 예, 골무기질밀도 ) pqct ( 말초정량적전산화단층촬영 ) 및 DXA ( 이중에너지 X-선흡수계측 ) 의평가를위해, 연구개시전에 ( 기저값을얻기위해 ) 및 1개월후에 (Mab의제2 투여전에 ), 및최종적으로추가분석 ( 예, 조직형태계측분석 ) 을위해마우스를검시하는시점인연구의말미 (2개월시점 ) 에스캔을수행하였다. 동력학조직형태계측을위해동물을플루오로크롬표지시켰다 ( 제14일, 제24일, 제47일및제57일 ). 혈청을본연구동안다양한시점에수집하였다 [ 제1일예비- 투여 ( 제1 Mab 투여일 ), 제1일투여후 12시간, 제2일, 제3일, 제5일, 제7일, 제14일, 제21일, 제28일, 제29일투여후 12시간 ( 제29일은제2 및최종 Mab 투여일임 ), 제30일, 제31일, 제33일, 제35일, 제42일, 제49일및제 56일 ]. 상업적으로입수가능한키트를이용하여 3종의골-관련혈청생체마커를측정하였다 : 오스테오칼신 (OC) (DSL 오스테오칼신방사선면역검정키트 ; 미국텍사스주웹스터소재의다이아그노스틱시스템즈래보라토리즈, 인크.(Diagnostic Systems Laboratories, Inc.)) 제I형프로콜라겐의 N-말단프로펩티드 (P1NP) (P1NP 방사선면역검정키트 ; 필란드에스푸소재의오리온다이아그노스틱카 (Orion Diagnostica)) 콜라겐제I형알사슬의 C-텔로펩티드단편 (sctxi) ( 세럼크로스랩스 (Serum CrossLaps ) ELISA; 덴마크헬레브소재의노르딕바이오사이언스다이아그노스틱스 AJS(Nordic Bioscience Diagnostics AJS)) pqct 및 DXA 스캔은다수의골격부위 ( 경골골간단및골간, 방사상골간단및골간, 대퇴골경부, 요추골포함 ) 를횡단하여다양한골파라미터 ( 골무기질밀도 (BMD) 및골무기질함량포함 ) 에대한데이타를수득하였다. 골데이타 ( 각동물에대한기저선으로부터의변화율 ) 및동화 (OC, P1NP) 혈청생체마커데이타 ( 각동물에대한기저선으로부터의변화율 ) 의분석은, 비히클집단에비해, 각 Mab에대한특정시점및투여량의특정파라미터에서통계학상유의적인증가를나타냈다. 이러한골파라미터데이타, 혈청생체마커데이타, 뿐만아니라조직형태계측데이타는각 3 Mab (Ab-23, Ab-5 및 Ab-14) 가시노몰구스원숭이에서스클레로스틴을중화시킬수있음을나타냈다. 이러한활성은 Ab-23 및 Ab-5에대해, 특히가장높은투여량 (30 mg/kg) 에서, 골형성 ( 동화효과 ) 에서의명백한증가뿐만아니라골에서알짜이익 ( 예, BMD) 을가지면서가장왕성하였다. 골파라미터및동화조직형태계측파라미터에서통계학상유의적인증가를양성대조군집단 (PTH (1-34)) 에대해또한발견하였다. 혈청골형성마커 (P1NP, 오스테오칼신 ) 는다양한시점및투여량에서, 특히 Ab-23 및 Ab-5에대해 30 mg/kg 집단에서증가하였다 (p<0.05 대비히클 (VEH)). 조직형태계측분석은, Ab-23 및 Ab-5의가장높은투여량에서, 요부척추골및근위경골 (5-배이하증가 ) 및대퇴골골간의내피질표면 (10-배이하증가 ) 의해면골에서골형성비율에있어서현저한증가 (p<0.05 대 VEH) 를나타냈다. 잔기둥두께는요추골에서높은투여량의 Ab-23 및 Ab-5를사용하여증가되었다 (>60%, p<0.05 대 VEH). 연구말미 (2개월) 에, 기저선으로부터의변화율로서면적 BMD는대퇴골경부, 원위요골 (Ab-23, 30 mg/kg) 및요추골 (Ab-5, 30 mg/kg) 에서증가하였다 (p<0.05 대 VEH). 요추골에서면적 BMD의증가는척추골강도 (Ab-23에대해척추골최대하중에있어서 97% 증가, 30 mg/kg; p<0.05 대 VEH) 의증가를수반하였으며 ; Mab 투여전요부면적 BMD에대한기저값은모든집단에대해통계학적으로유사하였다. 요약하자면, 시노골구스원숭이에서스클레로스틴-중화 Mab의단기간
105 투여는부분적으로골형성, BMD 및척추골골강도를증가시켰다. [1057] 상기로부터, 본발명의특정실시양태는예시목적을위해본원에기재되었지만, 다양한변형이본발명의취지 및범위로부터벗어나지않는한행해질수있다. 따라서, 본발명은첨부되는청구의범위를제외하고는제한 되지않는다. 본원에개시된모든출원, 공개특허출원, 및특허문헌은참고로본원에포함된다. 도면 도면
106 도면
107 도면
108 도면
109 도면
110 도면
111 도면
112 도면 8 도면
113 도면
114 도면
115 도면
116 도면
117 도면
118 도면 15 도면
Jkafm093.hwp
 가정의학회지 2004;25:721-739 비만은 심혈관 질환, 고혈압 및 당뇨병에 각각 위험요인이고 다양한 내과적, 심리적 장애와 연관이 있는 질병이다. 체중감소는 비만한 사람들에 있어 이런 위험을 감소시키고 이들 병발 질환을 호전시킨다고 알려져 있고 일반적으로 많은 사람들에게 건강을 호전시킬 것이라는 믿음이 있어 왔다. 그러나 이런 믿음을 지지하는 연구들은
가정의학회지 2004;25:721-739 비만은 심혈관 질환, 고혈압 및 당뇨병에 각각 위험요인이고 다양한 내과적, 심리적 장애와 연관이 있는 질병이다. 체중감소는 비만한 사람들에 있어 이런 위험을 감소시키고 이들 병발 질환을 호전시킨다고 알려져 있고 일반적으로 많은 사람들에게 건강을 호전시킬 것이라는 믿음이 있어 왔다. 그러나 이런 믿음을 지지하는 연구들은
특허청구의 범위 청구항 1 복수개의 프리캐스트 콘크리트 부재(1)를 서로 결합하여 연속화시키는 구조로서, 삽입공이 형성되어 있고 상기 삽입공 내면에는 나사부가 형성되어 있는 너트형 고정부재(10)가, 상기 프리캐스 트 콘크리트 부재(1) 내에 내장되도록 배치되는 내부
 (19) 대한민국특허청(KR) (12) 등록특허공보(B1) (51) 국제특허분류(Int. Cl.) E01D 19/12 (2006.01) E01D 2/00 (2006.01) E01D 21/00 (2006.01) (21) 출원번호 10-2011-0036938 (22) 출원일자 2011년04월20일 심사청구일자 2011년04월20일 (65) 공개번호 10-2012-0119156
(19) 대한민국특허청(KR) (12) 등록특허공보(B1) (51) 국제특허분류(Int. Cl.) E01D 19/12 (2006.01) E01D 2/00 (2006.01) E01D 21/00 (2006.01) (21) 출원번호 10-2011-0036938 (22) 출원일자 2011년04월20일 심사청구일자 2011년04월20일 (65) 공개번호 10-2012-0119156
- 2 -
 터키 / 공통 가이드라인명 GMP Kılavuzu GMP 가이드라인 제정일 상위법 Ÿ Ÿ 제정배경 범위 주요내용 Ÿ Ÿ Ÿ Ÿ Ÿ Ÿ Ÿ 의약품제조시, 제조허가증, 의약품의용도및판매허가요구사항, 안정성, 품질및품질부적합으로인한피해로환자가발생하지않도록제조하기위함임. 화학합성의약품, 생물의약품, 방사성의약품, 임상시험용의약품, 무균의약품, 사람혈액및혈장의약품,
터키 / 공통 가이드라인명 GMP Kılavuzu GMP 가이드라인 제정일 상위법 Ÿ Ÿ 제정배경 범위 주요내용 Ÿ Ÿ Ÿ Ÿ Ÿ Ÿ Ÿ 의약품제조시, 제조허가증, 의약품의용도및판매허가요구사항, 안정성, 품질및품질부적합으로인한피해로환자가발생하지않도록제조하기위함임. 화학합성의약품, 생물의약품, 방사성의약품, 임상시험용의약품, 무균의약품, 사람혈액및혈장의약품,
untitled
 노인골다공증치료의선택 정호연 경희대학교의과대학동서신의학병원내분비대사내과학교실 서 론 골다공증은골강도가약해져서골절이증가되는질환으로폐경이후나노인에서잘관찰된다. 2002년이후우리나라의여성의평균수명은 80세를넘어섰으며 60세이상노인인구의증가는골다공증골절의유병율을증가시키고있다. 국민건강영양조사에따르면골다공증유병건수는 1998년인구 1,000명당 2.87명으로보고되었으나
노인골다공증치료의선택 정호연 경희대학교의과대학동서신의학병원내분비대사내과학교실 서 론 골다공증은골강도가약해져서골절이증가되는질환으로폐경이후나노인에서잘관찰된다. 2002년이후우리나라의여성의평균수명은 80세를넘어섰으며 60세이상노인인구의증가는골다공증골절의유병율을증가시키고있다. 국민건강영양조사에따르면골다공증유병건수는 1998년인구 1,000명당 2.87명으로보고되었으나
2016 학년도약학대학면접문제해설 문제 2 아래의질문에 3-4분이내로답하시오. 표피성장인자수용체 (epidermal growth factor receptor, EGFR) 는수용체티로신인산화효소군 (receptor tyrosine kinases, RTKs) 의일종으로서세
 본문제에대한지적소유권은동국대학교에있습니다. 본교의서면허락없이무단으로출판, 게재, 사용할수없습니다. 문제 2 2016 학년도약학대학면접문제 아래의질문에 3-4 분이내로답하시오. 표피성장인자수용체 (epidermal growth factor receptor, EGFR) 는수용체티로신 인산화효소군 (receptor tyrosine kinases, RTKs) 의일종으로서세포의생존과증식
본문제에대한지적소유권은동국대학교에있습니다. 본교의서면허락없이무단으로출판, 게재, 사용할수없습니다. 문제 2 2016 학년도약학대학면접문제 아래의질문에 3-4 분이내로답하시오. 표피성장인자수용체 (epidermal growth factor receptor, EGFR) 는수용체티로신 인산화효소군 (receptor tyrosine kinases, RTKs) 의일종으로서세포의생존과증식
(52) CPC 특허분류 C07K 16/2809 ( ) C07K 16/283 ( ) C07K 16/32 ( ) C07K 16/44 ( ) A61K 2039/505 ( ) C07K 2317/34 ( ) C0
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) A61K 39/395 (2006.01) A61K 39/00 (2006.01) C07K 16/28 (2006.01) C07K 16/32 (2006.01) C07K 16/44 (2006.01) (52) CPC 특허분류 A61K 39/395 (2013.01) C07K
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) A61K 39/395 (2006.01) A61K 39/00 (2006.01) C07K 16/28 (2006.01) C07K 16/32 (2006.01) C07K 16/44 (2006.01) (52) CPC 특허분류 A61K 39/395 (2013.01) C07K
 1607 - 1 - - 2 - - 3 - 그림 1-4 - - 5 - 그림 3 농도에따른댓잎추출액의항세균효과 - 6 - 그림 4 한천확산법 그림 5 배지에균뿌리는과정 그림 6 배지에균스프레딩하는과정 표 1 실험에사용한미생물의종류와배양에사용한배지 Bacterial Strain Gram (+) bacteria Rothia dentocariosa G1201 Streptococcus
1607 - 1 - - 2 - - 3 - 그림 1-4 - - 5 - 그림 3 농도에따른댓잎추출액의항세균효과 - 6 - 그림 4 한천확산법 그림 5 배지에균뿌리는과정 그림 6 배지에균스프레딩하는과정 표 1 실험에사용한미생물의종류와배양에사용한배지 Bacterial Strain Gram (+) bacteria Rothia dentocariosa G1201 Streptococcus
½Ç°ú¸Ó¸®¸»¸ñÂ÷ÆDZÇ(1-5)¿Ï
 실과056-094 2013.1.9 7:22 PM 페이지67 MDPREP_RipControl 2007 개정 5학년 검정 지도서 각론 알짜 정리 67 영양소 힘을 내는 일(탄수화물/지방/단백질) 몸의 조직 구성(지방/단백질/무기질/물) 몸의 기능 조절(단백질/무기질/비타민/물) 식품 구성 자전거의 식품과 영양소 식품군 곡류 탄수화물 우리가 활동하는데 필요한 힘을
실과056-094 2013.1.9 7:22 PM 페이지67 MDPREP_RipControl 2007 개정 5학년 검정 지도서 각론 알짜 정리 67 영양소 힘을 내는 일(탄수화물/지방/단백질) 몸의 조직 구성(지방/단백질/무기질/물) 몸의 기능 조절(단백질/무기질/비타민/물) 식품 구성 자전거의 식품과 영양소 식품군 곡류 탄수화물 우리가 활동하는데 필요한 힘을
공개특허 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) Int. Cl. C07K 16/46 ( ) C07K 14/315 ( ) C12N 15/13 ( ) A61K 39/09 (2006.
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) Int. Cl. C07K 16/46 (2006.01) C07K 14/315 (2006.01) C12N 15/13 (2006.01) A61K 39/09 (2006.01) (11) 공개번호 (43) 공개일자 10-2007-0085236 2007 년 08 월 27 일 (21) 출원번호 10-2007-7006758
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) Int. Cl. C07K 16/46 (2006.01) C07K 14/315 (2006.01) C12N 15/13 (2006.01) A61K 39/09 (2006.01) (11) 공개번호 (43) 공개일자 10-2007-0085236 2007 년 08 월 27 일 (21) 출원번호 10-2007-7006758
저작자표시 - 동일조건변경허락 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 이차적저작물을작성할수있습니다. 이저작물을영리목적으로이용할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원
 저작자표시 - 동일조건변경허락 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 이차적저작물을작성할수있습니다. 이저작물을영리목적으로이용할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원저작자를표시하여야합니다. 동일조건변경허락. 귀하가이저작물을개작, 변형또는가공했을경우에는, 이저작물과동일한이용허락조건하에서만배포할수있습니다.
저작자표시 - 동일조건변경허락 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 이차적저작물을작성할수있습니다. 이저작물을영리목적으로이용할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원저작자를표시하여야합니다. 동일조건변경허락. 귀하가이저작물을개작, 변형또는가공했을경우에는, 이저작물과동일한이용허락조건하에서만배포할수있습니다.
특허청구의범위청구항 1 사람 TNFα 항체로치료한후의강직성척추염 (AS) 환자로부터의콜라겐분해바이오마커및 / 또는활막염 (synovitis) 바이오마커의사전측정된수준을, 상기질환상태와관련된콜라겐분해바이오마커및 / 또는활막염바이오마커의공지된표준수준과비교하고 ; 상기환자의
 (51) Int. Cl. (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) G01N 33/542 (2006.01) C12M 3/00 (2006.01) (21) 출원번호 10-2008-7010615 (22) 출원일자 2008 년 04 월 30 일 심사청구일자 없음 번역문제출일자 2008 년 04 월 30 일 (86) 국제출원번호 PCT/US2006/042564
(51) Int. Cl. (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) G01N 33/542 (2006.01) C12M 3/00 (2006.01) (21) 출원번호 10-2008-7010615 (22) 출원일자 2008 년 04 월 30 일 심사청구일자 없음 번역문제출일자 2008 년 04 월 30 일 (86) 국제출원번호 PCT/US2006/042564
특허청구의범위청구항 1 인간화항체또는그것의항원결합단편으로서, 상기항체또는상기단편은, (a) ATCC 기탁번호 PTA-5958의클론 1D5에의해얻어지는모노클로날항체의여섯개의 CDR을포함하여이루어지거나, (b) ATCC 기탁번호 PTA-5961의클론 2E1에의해얻어지는모노
 (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (51) 국제특허분류 (Int. Cl.) C07K 16/00 (2006.01) A61K 39/395 (2006.01) A61K 39/42 (2006.01) (21) 출원번호 10-2006-7025895 (22) 출원일자 ( 국제 ) 2005 년 05 월 10 일 심사청구일자 2010 년 04 월
(19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (51) 국제특허분류 (Int. Cl.) C07K 16/00 (2006.01) A61K 39/395 (2006.01) A61K 39/42 (2006.01) (21) 출원번호 10-2006-7025895 (22) 출원일자 ( 국제 ) 2005 년 05 월 10 일 심사청구일자 2010 년 04 월
Jkbcs016(92-97).hwp
 Expression of bcl-2 and Apoptosis and Its Relationship to Clinicopathological Prognostic Factors in Breast Cancer - A Study with Long Term Follow-up correlated with the survival rate.(journal of Korean
Expression of bcl-2 and Apoptosis and Its Relationship to Clinicopathological Prognostic Factors in Breast Cancer - A Study with Long Term Follow-up correlated with the survival rate.(journal of Korean
<BBFDC8ADC7D02E687770>
 대상본과 1 학년담당교수손정원 2014. 4. 1. 3/4 교시장소 1 의학관제 1 강의실 2. 수업주제 단백질 folding, targeting, 분해 1) 단백질 folding의기본동력에대해서이해한다. 2) chaperone의종류와작용기전에대하여설명한다. 3) proteasome의구조와 proteasome에의한단백질분해에대하여설명한다. 4) ER targeting
대상본과 1 학년담당교수손정원 2014. 4. 1. 3/4 교시장소 1 의학관제 1 강의실 2. 수업주제 단백질 folding, targeting, 분해 1) 단백질 folding의기본동력에대해서이해한다. 2) chaperone의종류와작용기전에대하여설명한다. 3) proteasome의구조와 proteasome에의한단백질분해에대하여설명한다. 4) ER targeting
목차 1. 서론 줄기세포의간세포분화능평가시고려사항 간세포분화능평가시험법 분
 세포치료제시험정보집 7 줄기세포치료제의 간세포분화능평가시험 2015. 4. 30. 식품의약품안전평가원 차세대줄기세포기반제제평가연구사업단 목차 1. 서론 --------------------------------------------- 1 2. 줄기세포의간세포분화능평가시고려사항 --------------- 2 3. 간세포분화능평가시험법 -----------------------------
세포치료제시험정보집 7 줄기세포치료제의 간세포분화능평가시험 2015. 4. 30. 식품의약품안전평가원 차세대줄기세포기반제제평가연구사업단 목차 1. 서론 --------------------------------------------- 1 2. 줄기세포의간세포분화능평가시고려사항 --------------- 2 3. 간세포분화능평가시험법 -----------------------------
<4D F736F F F696E74202D203137C0E55FBFACBDC0B9AEC1A6BCD6B7E7BCC72E707074>
 SIMATIC S7 Siemens AG 2004. All rights reserved. Date: 22.03.2006 File: PRO1_17E.1 차례... 2 심벌리스트... 3 Ch3 Ex2: 프로젝트생성...... 4 Ch3 Ex3: S7 프로그램삽입... 5 Ch3 Ex4: 표준라이브러리에서블록복사... 6 Ch4 Ex1: 실제구성을 PG 로업로드하고이름변경......
SIMATIC S7 Siemens AG 2004. All rights reserved. Date: 22.03.2006 File: PRO1_17E.1 차례... 2 심벌리스트... 3 Ch3 Ex2: 프로젝트생성...... 4 Ch3 Ex3: S7 프로그램삽입... 5 Ch3 Ex4: 표준라이브러리에서블록복사... 6 Ch4 Ex1: 실제구성을 PG 로업로드하고이름변경......
(72) 발명자 김도규 서울특별시성북구장위 3 동 박준일 서울특별시강서구등촌동 서광아파트 103 동 803 호 유형규 경기도광명시광명 4 동한진아파트 101 동 1801 호 - 2 -
 (51) Int. Cl. (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) F25B 30/06 (2006.01) (21) 출원번호 10-2008-0088941 (22) 출원일자 2008 년 09 월 09 일 심사청구일자 전체청구항수 : 총 7 항 2008 년 09 월 09 일 (54) 지중열교환기의공급파이프 (11) 공개번호 10-2010-0030143
(51) Int. Cl. (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) F25B 30/06 (2006.01) (21) 출원번호 10-2008-0088941 (22) 출원일자 2008 년 09 월 09 일 심사청구일자 전체청구항수 : 총 7 항 2008 년 09 월 09 일 (54) 지중열교환기의공급파이프 (11) 공개번호 10-2010-0030143
특허청구의범위청구항 1 삭제청구항 2 삭제청구항 3 삭제청구항 4 삭제청구항 5 삭제청구항 6 삭제청구항 7 삭제청구항 8 삭제청구항 9 삭제청구항 10 삭제청구항 11 삭제청구항 12 삭제청구항 13 삭제청구항 14 삭제청구항 15 삭제청구항
 (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (51) 국제특허분류 (Int. Cl.) A61K 39/395 (2006.01) A61K 47/06 (2006.01) A61K 47/18 (2006.01) (21) 출원번호 10-2005-7018843 (22) 출원일자 ( 국제 ) 2004 년 03 월 29 일 심사청구일자 2009 년 03 월
(19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (51) 국제특허분류 (Int. Cl.) A61K 39/395 (2006.01) A61K 47/06 (2006.01) A61K 47/18 (2006.01) (21) 출원번호 10-2005-7018843 (22) 출원일자 ( 국제 ) 2004 년 03 월 29 일 심사청구일자 2009 년 03 월
생명과학의 이해
 3. 생명현상의 화학적이해 1. 생명체주요원소 2. 생명체주요분자 3. 4. ATP 5. 물 1 1. 생명체주요원소 세포를구성하고있는원소비율원소무게 (%) 1. 산소 (O) 62.00 2. 탄소 (C) 20.00 주성분원소 3. 질소 (N) 10.00 ( 약 95%) 세포를구성하고정상적인기능을위해필요한원소는약 25 종 4. 수소 (H) 3.00 5. 칼슘 (Ca)
3. 생명현상의 화학적이해 1. 생명체주요원소 2. 생명체주요분자 3. 4. ATP 5. 물 1 1. 생명체주요원소 세포를구성하고있는원소비율원소무게 (%) 1. 산소 (O) 62.00 2. 탄소 (C) 20.00 주성분원소 3. 질소 (N) 10.00 ( 약 95%) 세포를구성하고정상적인기능을위해필요한원소는약 25 종 4. 수소 (H) 3.00 5. 칼슘 (Ca)
붙임2-1. 건강영향 항목의 평가 매뉴얼(협의기관용, '13.12).hwp
 환경영향평가서내위생 공중보건항목작성을위한건강영향항목의평가매뉴얼 - 협의기관용 - 2013. 12 환경부환경보건정책관실 - i - - ii - - iii - - iv - - v - - vi - 제 1 장건강영향평가의개요 건강영향평가의정의건강영향평가제도의필요성건강영향평가의목적및기능건강영향평가의원칙건강결정요인 - 1 - - 2 - - 3 - 제 2 장건강영향평가제도의시행방안
환경영향평가서내위생 공중보건항목작성을위한건강영향항목의평가매뉴얼 - 협의기관용 - 2013. 12 환경부환경보건정책관실 - i - - ii - - iii - - iv - - v - - vi - 제 1 장건강영향평가의개요 건강영향평가의정의건강영향평가제도의필요성건강영향평가의목적및기능건강영향평가의원칙건강결정요인 - 1 - - 2 - - 3 - 제 2 장건강영향평가제도의시행방안
등록특허 (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (45) 공고일자 2014년02월04일 (11) 등록번호 (24) 등록일자 2014년01월24일 (51) 국제특허분류 (Int. Cl.) C08L 79/08
 (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (45) 공고일자 2014년02월04일 (11) 등록번호 10-1357648 (24) 등록일자 2014년01월24일 (51) 국제특허분류 (Int. Cl.) C08L 79/08 (2006.01) C08K 3/34 (2006.01) C08L 101/12 (2006.01) C08L 33/12 (2006.01)
(19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (45) 공고일자 2014년02월04일 (11) 등록번호 10-1357648 (24) 등록일자 2014년01월24일 (51) 국제특허분류 (Int. Cl.) C08L 79/08 (2006.01) C08K 3/34 (2006.01) C08L 101/12 (2006.01) C08L 33/12 (2006.01)
(72) 발명자 즈홍즈헨샤오 미국메릴랜드주 노쓰포토맥 #204 매러턴테라스 9619 오덴헤이머다니엘 미국메릴랜드주 록크빌크로스헤븐코트 퍼킨스멜리사디 미국메릴랜드주 저먼타운포터필드웨이 (30) 우선권주장 60/725,
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) G01N 33/53 (2006.01) G01N 33/68 (2006.01) A61K 39/395 (2006.01) A61K 38/19 (2006.01) (21) 출원번호 10-2014-7011916( 분할 ) (22) 출원일자 ( 국제 ) 2006 년 10
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) G01N 33/53 (2006.01) G01N 33/68 (2006.01) A61K 39/395 (2006.01) A61K 38/19 (2006.01) (21) 출원번호 10-2014-7011916( 분할 ) (22) 출원일자 ( 국제 ) 2006 년 10
< 서식 5> 탐구보고서표지 제 25 회서울학생탐구발표대회보고서 출품번호 유글레나를이용한산소발생환경의탐구 소속청학교명학년성명 ( 팀명 ) 강서교육청서울백석중학교 3 임산해 [ 팀원이름 ]
![< 서식 5> 탐구보고서표지 제 25 회서울학생탐구발표대회보고서 출품번호 유글레나를이용한산소발생환경의탐구 소속청학교명학년성명 ( 팀명 ) 강서교육청서울백석중학교 3 임산해 [ 팀원이름 ] < 서식 5> 탐구보고서표지 제 25 회서울학생탐구발표대회보고서 출품번호 유글레나를이용한산소발생환경의탐구 소속청학교명학년성명 ( 팀명 ) 강서교육청서울백석중학교 3 임산해 [ 팀원이름 ]](/thumbs/97/133534027.jpg) < 서식 5> 탐구보고서표지 제 25 회서울학생탐구발표대회보고서 출품번호 유글레나를이용한산소발생환경의탐구 2010. 09. 28. 소속청학교명학년성명 ( 팀명 ) 강서교육청서울백석중학교 3 임산해 [ 팀원이름 ] 목 차 Ⅰ. 탐구주제 02 Ⅱ. 탐구하게된동기 02 Ⅲ. 배경이론 02 1. 유글레나의특징가. ph 나. 온도 Ⅳ. 선행연구고찰 03 1. 산소결핍과인체에미치는영향
< 서식 5> 탐구보고서표지 제 25 회서울학생탐구발표대회보고서 출품번호 유글레나를이용한산소발생환경의탐구 2010. 09. 28. 소속청학교명학년성명 ( 팀명 ) 강서교육청서울백석중학교 3 임산해 [ 팀원이름 ] 목 차 Ⅰ. 탐구주제 02 Ⅱ. 탐구하게된동기 02 Ⅲ. 배경이론 02 1. 유글레나의특징가. ph 나. 온도 Ⅳ. 선행연구고찰 03 1. 산소결핍과인체에미치는영향
기술명 업체명 동물세포를활용한인간재조합골형성단백질 (rhbmp2) 함유골이식재의 제조기술 ( 주 ) 코리아본뱅크 1. 기술의용도및기능 용도 : 골손상, 골결함발생시이를대체, 수복, 재건할수있도록충진하는골이식재제조 기술로정형외과, 신경외과, 치과분야에서사용됨. o 인체조
 기술명 업체명 동물세포를활용한인간재조합골형성단백질 (rhbmp2) 함유골이식재의 제조기술 ( 주 ) 코리아본뱅크 1. 기술의용도및기능 용도 : 골손상, 골결함발생시이를대체, 수복, 재건할수있도록충진하는골이식재제조 기술로정형외과, 신경외과, 치과분야에서사용됨. o 인체조직은크게지지체, 성장인자, 세포로구성된다고볼수있으며, 인체골조직역시 HA 및콜라겐의복합체인일종의지지체,
기술명 업체명 동물세포를활용한인간재조합골형성단백질 (rhbmp2) 함유골이식재의 제조기술 ( 주 ) 코리아본뱅크 1. 기술의용도및기능 용도 : 골손상, 골결함발생시이를대체, 수복, 재건할수있도록충진하는골이식재제조 기술로정형외과, 신경외과, 치과분야에서사용됨. o 인체조직은크게지지체, 성장인자, 세포로구성된다고볼수있으며, 인체골조직역시 HA 및콜라겐의복합체인일종의지지체,
특허청구의 범위 청구항 1. 1종 이상의 병원체 폴리펩티드가 임의의 균주로부터 제시되지 않는, 개별 대상체에 존재하는 병원체의 다중 균주로부터의 1종 이상의 폴리펩티드를 코딩하는 핵산을 포함하는 단리된 항원 제시 세포 (APC). 청구항 2. 제1항에 있어서, 상기 핵
 (19)대한민국특허청(KR) (12) 공개특허공보(A) (51) Int. Cl. C12Q 1/70 (2006.01) C12Q 1/68 (2006.01) (11) 공개번호 (43) 공개일자 10-2007-0058503 2007년06월08일 (21) 출원번호 10-2007-7005912 (22) 출원일자 2007년03월14일 심사청구일자 없음 번역문 제출일자 2007년03월14일
(19)대한민국특허청(KR) (12) 공개특허공보(A) (51) Int. Cl. C12Q 1/70 (2006.01) C12Q 1/68 (2006.01) (11) 공개번호 (43) 공개일자 10-2007-0058503 2007년06월08일 (21) 출원번호 10-2007-7005912 (22) 출원일자 2007년03월14일 심사청구일자 없음 번역문 제출일자 2007년03월14일
(72) 발명자 산나피트로파올로 미국 캘리포니아주샌디에고휘티어스트리트 3443 버튼데니스알 미국 캘리포니아주라졸라보몬트애비뉴 6044 크로우제임스 미국 테네시주내시빌사우스 20 번애비뉴 2101 윌리엄스존브이 미국 테네시주내시
 (51) Int. Cl. (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) C07K 16/18 (2006.01) G01N 33/569 (2006.01) C12Q 1/70 (2006.01) (21) 출원번호 10-2009-7009163 (22) 출원일자 2007 년 10 월 04 일 심사청구일자 없음 (85) 번역문제출일자 2009 년 05 월 01
(51) Int. Cl. (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) C07K 16/18 (2006.01) G01N 33/569 (2006.01) C12Q 1/70 (2006.01) (21) 출원번호 10-2009-7009163 (22) 출원일자 2007 년 10 월 04 일 심사청구일자 없음 (85) 번역문제출일자 2009 년 05 월 01
특허청구의범위청구항 1 물을여과하는필터부 ; 상기필터부에물을유동시키는정수관 ; 상기정수관에설치되고, 상기정수관의수류를이용하여전기를발생시키는발전모듈 ; 및상기정수관에배치되고, 상기발전모듈에서발생된전기가공급되고, 상기정수관을따라유동되는정수를전기분해하여살균하는살균모듈 ; 을
 (51) Int. Cl. (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) B01D 35/00 (2006.01) C02F 1/461 (2006.01) C02F 1/467 (2006.01) (21) 출원번호 10-2009-0019000 (22) 출원일자 2009 년 03 월 05 일 심사청구일자 없음 전체청구항수 : 총 4 항 (54) 정수기 (11)
(51) Int. Cl. (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) B01D 35/00 (2006.01) C02F 1/461 (2006.01) C02F 1/467 (2006.01) (21) 출원번호 10-2009-0019000 (22) 출원일자 2009 년 03 월 05 일 심사청구일자 없음 전체청구항수 : 총 4 항 (54) 정수기 (11)
특허청구의범위청구항 1 복수의영상검출부로부터출력되는영상의히스토그램 (histogram) 을계산하는단계 ; 상기복수의영상검출부로부터출력되는영상을히스토그램평활화 (histogram equalization) 하는단계 ; 상기복수의영상검출부중하나의영상검출부를선택하는단계 ; 및
 (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (45) 공고일자 2014년12월18일 (11) 등록번호 10-1473415 (24) 등록일자 2014년12월10일 (51) 국제특허분류 (Int. Cl.) G06T 5/40 (2006.01) H04N 5/217 (2011.01) (21) 출원번호 10-2012-0156871 (22) 출원일자 2012
(19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (45) 공고일자 2014년12월18일 (11) 등록번호 10-1473415 (24) 등록일자 2014년12월10일 (51) 국제특허분류 (Int. Cl.) G06T 5/40 (2006.01) H04N 5/217 (2011.01) (21) 출원번호 10-2012-0156871 (22) 출원일자 2012
<5BB0EDB3ADB5B55D32303131B3E2B4EBBAF12DB0ED312D312DC1DFB0A32DC0B6C7D5B0FAC7D02D28312E28322920BAF2B9F0B0FA20BFF8C0DAC0C720C7FCBCBA2D3031292D3135B9AEC7D72E687770>
 고1 융합 과학 2011년도 1학기 중간고사 대비 다음 글을 읽고 물음에 답하시오. 1 빅뱅 우주론에서 수소와 헬륨 의 형성에 대한 설명으로 옳은 것을 보기에서 모두 고른 것은? 4 서술형 다음 그림은 수소와 헬륨의 동위 원 소의 을 모형으로 나타낸 것이. 우주에서 생성된 수소와 헬륨 의 질량비 는 약 3:1 이. (+)전하를 띠는 양성자와 전기적 중성인 중성자
고1 융합 과학 2011년도 1학기 중간고사 대비 다음 글을 읽고 물음에 답하시오. 1 빅뱅 우주론에서 수소와 헬륨 의 형성에 대한 설명으로 옳은 것을 보기에서 모두 고른 것은? 4 서술형 다음 그림은 수소와 헬륨의 동위 원 소의 을 모형으로 나타낸 것이. 우주에서 생성된 수소와 헬륨 의 질량비 는 약 3:1 이. (+)전하를 띠는 양성자와 전기적 중성인 중성자
2차 수사분석사례집_최종.hwp
 1 발간사 최근국민소득의향상과 100세시대도래로인한수명의연장등으로건강에대한열망과관심이급증하고있습니다. 건강한삶을추구하기위하여식품이나건강기능식품등의소비가증가하고있으며, 이에따라건강기능식품시장이엄청나게활성화되고있습니다. 하지만부정 불법으로의약품성분이나그유사물질을식품이나건강기능식품등에혼입하거나의약품을불법제조 유통하는사례가빈발하여소비자가섭취시부작용과위해성에노출되어있는실정이며식
1 발간사 최근국민소득의향상과 100세시대도래로인한수명의연장등으로건강에대한열망과관심이급증하고있습니다. 건강한삶을추구하기위하여식품이나건강기능식품등의소비가증가하고있으며, 이에따라건강기능식품시장이엄청나게활성화되고있습니다. 하지만부정 불법으로의약품성분이나그유사물질을식품이나건강기능식품등에혼입하거나의약품을불법제조 유통하는사례가빈발하여소비자가섭취시부작용과위해성에노출되어있는실정이며식
저작자표시 - 비영리 - 변경금지 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원저작자를표시하여야합니다. 비영리. 귀하는이저작물을영리목적으로이용할
 저작자표시 - 비영리 - 변경금지 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원저작자를표시하여야합니다. 비영리. 귀하는이저작물을영리목적으로이용할수없습니다. 변경금지. 귀하는이저작물을개작, 변형또는가공할수없습니다. 귀하는, 이저작물의재이용이나배포의경우,
저작자표시 - 비영리 - 변경금지 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원저작자를표시하여야합니다. 비영리. 귀하는이저작물을영리목적으로이용할수없습니다. 변경금지. 귀하는이저작물을개작, 변형또는가공할수없습니다. 귀하는, 이저작물의재이용이나배포의경우,
제1장 생리학 소개
 제 5 장 벡터 벡터 (vector); 의학적의미의전달자예 ; 말라리아병원균을옮기는모기 분자생물학이나유전공학에서의벡터플라스미드나박테리오파지와같은 DNA 로서, 세포형질전환을통해특정유전자나 DNA 를자신에삽입시켜재조합 DNA 를만든후, 이것을숙주세포로전달하여많은수로복제될수있도록하거나또는단백질로발현될수있도록하는 DNA 운반체 클로닝벡터 (cloning vector)
제 5 장 벡터 벡터 (vector); 의학적의미의전달자예 ; 말라리아병원균을옮기는모기 분자생물학이나유전공학에서의벡터플라스미드나박테리오파지와같은 DNA 로서, 세포형질전환을통해특정유전자나 DNA 를자신에삽입시켜재조합 DNA 를만든후, 이것을숙주세포로전달하여많은수로복제될수있도록하거나또는단백질로발현될수있도록하는 DNA 운반체 클로닝벡터 (cloning vector)
Regulation on Approval of Consumer Chemical Products subject to Safety Check without promulgated Safety Standard.hwp
 - 1 - - 2 - - 3 - - 4 - - 5 - - 6 - - 7 - - 8 - - 9 - - 10 - - 11 - - 12 - - 13 - - 14 - - 15 - - 16 - - 17 - - 18 - - 19 - 안전기준미고시안전확인대상생활화학제품의승인에관한규정 [ 별지제 1 호서식 ] 색상이어두운란은신고인이적지않습니다. 접수번호접수일시처리기간 상호
- 1 - - 2 - - 3 - - 4 - - 5 - - 6 - - 7 - - 8 - - 9 - - 10 - - 11 - - 12 - - 13 - - 14 - - 15 - - 16 - - 17 - - 18 - - 19 - 안전기준미고시안전확인대상생활화학제품의승인에관한규정 [ 별지제 1 호서식 ] 색상이어두운란은신고인이적지않습니다. 접수번호접수일시처리기간 상호
2. 원인 뼈에 가해진 외력을 견디지 못할 때 뼈는 부러지게 됩니다. 이러한 외력으로는 낙상, 자동차 사고, 추락 등이 있으며, 외 력의 양상에 따라 골절의 형태가 달라지게 됩니다. 3. 증상 뼈가 부러지면 극심한 통증이 동반되는데 주요 증상은 다음 과 같습니다. 1)
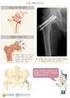 종합 병원 서 울 성 심 병 원 본 자료는 대한정형외과학회 학회지에 기재된 자료를 환자분들이 편하게 이용하실 수 있도록 재구성한 것입니다. 골 절 1. 개요 우리 몸에는 크고 작은 뼈가 200 여 개 있는데, 근육과 힘줄 로 서로 단단히 연결되어 뼈대를 이루고 있습니다. 뼈는 몸 속의 중요한 장기들을 보호하고, 혈액을 생성하며, 이동을 가 능하게 하는 중요한
종합 병원 서 울 성 심 병 원 본 자료는 대한정형외과학회 학회지에 기재된 자료를 환자분들이 편하게 이용하실 수 있도록 재구성한 것입니다. 골 절 1. 개요 우리 몸에는 크고 작은 뼈가 200 여 개 있는데, 근육과 힘줄 로 서로 단단히 연결되어 뼈대를 이루고 있습니다. 뼈는 몸 속의 중요한 장기들을 보호하고, 혈액을 생성하며, 이동을 가 능하게 하는 중요한
공개특허 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (11) 공개번호 (43) 공개일자 2010년07월09일 (51) Int. Cl. C12N 15/31 ( ) C12N 15/63 (
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (11) 공개번호 10-2010-0080591 (43) 공개일자 2010년07월09일 (51) Int. Cl. C12N 15/31 (2006.01) C12N 15/63 (2006.01) A61K 39/02 (2006.01) C07K 14/195 (2006.01) (21) 출원번호 10-2010-7004654
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (11) 공개번호 10-2010-0080591 (43) 공개일자 2010년07월09일 (51) Int. Cl. C12N 15/31 (2006.01) C12N 15/63 (2006.01) A61K 39/02 (2006.01) C07K 14/195 (2006.01) (21) 출원번호 10-2010-7004654
(72) 발명자 류쥔졘 미국매사추세츠주 슈루즈버리크림슨드라이브 14 오노르마리페. 미국매사추세츠주 웰즐리유니트 34 오크스트리트
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (11) 공개번호 10-2014-0015139 (43) 공개일자 2014년02월06일 (51) 국제특허분류 (Int. Cl.) C07K 16/28 (2006.01) C07K 16/22 (2006.01) C12N 15/13 (2006.01) A61K 39/395 (2006.01) (21) 출원번호 10-2012-7012401
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (11) 공개번호 10-2014-0015139 (43) 공개일자 2014년02월06일 (51) 국제특허분류 (Int. Cl.) C07K 16/28 (2006.01) C07K 16/22 (2006.01) C12N 15/13 (2006.01) A61K 39/395 (2006.01) (21) 출원번호 10-2012-7012401
세라뉴스-2011내지도큐
 2 2 8 17 18 22 23 24 Heinrich Wecker 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 예정된 이벤트 증례2 : 세라믹-폴리에틸렌 고관절 치환술후 발생한 비구-대퇴 해리로 세라믹-세라믹 관절면을 사용하여 재수술 진단 : 고관절 통증으로 내원한 65세 여자환자, 20년전 세라믹-폴리에틸
2 2 8 17 18 22 23 24 Heinrich Wecker 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 예정된 이벤트 증례2 : 세라믹-폴리에틸렌 고관절 치환술후 발생한 비구-대퇴 해리로 세라믹-세라믹 관절면을 사용하여 재수술 진단 : 고관절 통증으로 내원한 65세 여자환자, 20년전 세라믹-폴리에틸
* ** *** ****
 * ** *** **** - 47 - - 48 - - 49 - - 50 - - 51 - 구분범주빈도 ( 명 ) 비율 (%) 성별연령장애유형장애정도 남자 92 65.71 여자 48 34.28 3~6세 ( 학령전기 ) 70 50.00 7~10세 ( 학령기 ) 70 50.00 자폐성장애 53 37.85 지적장애 71 50.71 기타 16 11.42 경미한정도 31
* ** *** **** - 47 - - 48 - - 49 - - 50 - - 51 - 구분범주빈도 ( 명 ) 비율 (%) 성별연령장애유형장애정도 남자 92 65.71 여자 48 34.28 3~6세 ( 학령전기 ) 70 50.00 7~10세 ( 학령기 ) 70 50.00 자폐성장애 53 37.85 지적장애 71 50.71 기타 16 11.42 경미한정도 31
이 발명을 지원한 국가연구개발사업 과제고유번호 08921-01304 부처명 방송통신위원회 연구사업명 방송통신기술개발사업 연구과제명 안전한 전자파환경 조성 주관기관 한국전자통신연구원 연구기간 2008.01.01 ~ 2012.12.31-2 -
 (19) 대한민국특허청(KR) (12) 공개특허공보(A) (51) 국제특허분류(Int. Cl.) H05K 9/00 (2006.01) H04B 1/38 (2006.01) (21) 출원번호 10-2011-0134285 (22) 출원일자 2011년12월14일 심사청구일자 없음 기술이전 희망 : 기술양도, 실시권허여, 기술지도 전체 청구항 수 : 총 1 항 (54)
(19) 대한민국특허청(KR) (12) 공개특허공보(A) (51) 국제특허분류(Int. Cl.) H05K 9/00 (2006.01) H04B 1/38 (2006.01) (21) 출원번호 10-2011-0134285 (22) 출원일자 2011년12월14일 심사청구일자 없음 기술이전 희망 : 기술양도, 실시권허여, 기술지도 전체 청구항 수 : 총 1 항 (54)
(72) 발명자 오인환 서울 노원구 중계로 195, 101동 803호 (중계동, 신 안동진아파트) 서혜리 서울 종로구 평창14길 23, (평창동) 한훈식 서울 강남구 언주로71길 25-5, 301호 (역삼동, 영 훈하이츠) 이 발명을 지원한 국가연구개발사업 과제고유번호
 (19) 대한민국특허청(KR) (12) 등록특허공보(B1) (45) 공고일자 2014년04월14일 (11) 등록번호 10-1384704 (24) 등록일자 2014년04월07일 (51) 국제특허분류(Int. Cl.) F16L 9/18 (2006.01) F17D 1/00 (2006.01) F16L 3/00 (2006.01) (21) 출원번호 10-2012-0113933
(19) 대한민국특허청(KR) (12) 등록특허공보(B1) (45) 공고일자 2014년04월14일 (11) 등록번호 10-1384704 (24) 등록일자 2014년04월07일 (51) 국제특허분류(Int. Cl.) F16L 9/18 (2006.01) F17D 1/00 (2006.01) F16L 3/00 (2006.01) (21) 출원번호 10-2012-0113933
 유전자의전승 (Genetic Heritage) 일러두기 1 서론 3 제 장더러브렛유전자풀 - 기원 9 제 장더러브렛종을형성한위대한선대마들 59 제 장스피드와스태미나인자 95 제 장심장의크기와 X 요인의유전가능성 115 제 장부계혈통의생존 - 생식력과주기적기능 139 제 장세포의미토콘드리아와모계의중요성 175 제 장 BLANDFORD 가스태미나에미친영향
유전자의전승 (Genetic Heritage) 일러두기 1 서론 3 제 장더러브렛유전자풀 - 기원 9 제 장더러브렛종을형성한위대한선대마들 59 제 장스피드와스태미나인자 95 제 장심장의크기와 X 요인의유전가능성 115 제 장부계혈통의생존 - 생식력과주기적기능 139 제 장세포의미토콘드리아와모계의중요성 175 제 장 BLANDFORD 가스태미나에미친영향
목차 Ⅰ. 개요 1 Ⅱ. 용어의정의 4 Ⅲ. 관련규정 13 Ⅳ. 신청서기재항목및기술문서제출자료 14 Ⅴ. 제조 수입허가신청서기재항목 15
 체외진단용의료기기 ( 인플루엔자바이러스및 A형간염바이러스 ) 의허가 심사가이드라인 2015. 2. 의료기기심사부체외진단기기과 - 1 - 목차 Ⅰ. 개요 1 Ⅱ. 용어의정의 4 Ⅲ. 관련규정 13 Ⅳ. 신청서기재항목및기술문서제출자료 14 Ⅴ. 제조 수입허가신청서기재항목 15 Ⅵ. 기술문서등의심사를위한제출자료 37 Ⅶ. 성능시험에대한상세사항 44 Ⅷ. 참고문헌
체외진단용의료기기 ( 인플루엔자바이러스및 A형간염바이러스 ) 의허가 심사가이드라인 2015. 2. 의료기기심사부체외진단기기과 - 1 - 목차 Ⅰ. 개요 1 Ⅱ. 용어의정의 4 Ⅲ. 관련규정 13 Ⅳ. 신청서기재항목및기술문서제출자료 14 Ⅴ. 제조 수입허가신청서기재항목 15 Ⅵ. 기술문서등의심사를위한제출자료 37 Ⅶ. 성능시험에대한상세사항 44 Ⅷ. 참고문헌
USC HIPAA AUTHORIZATION FOR
 연구 목적의 건강정보 사용을 위한 USC HIPAA 승인 1. 본 양식의 목적: 건강보험 이전과 책임에 관한 법(Health Insurance Portability and Accountability Act, HIPAA)이라고 알려진 연방법은 귀하의 건강정보가 이용되는 방법을 보호합니다. HIPAA 는 일반적으로 귀하의 서면 동의 없이 연구를 목적으로 귀하의
연구 목적의 건강정보 사용을 위한 USC HIPAA 승인 1. 본 양식의 목적: 건강보험 이전과 책임에 관한 법(Health Insurance Portability and Accountability Act, HIPAA)이라고 알려진 연방법은 귀하의 건강정보가 이용되는 방법을 보호합니다. HIPAA 는 일반적으로 귀하의 서면 동의 없이 연구를 목적으로 귀하의
STATICS Page: 7-1 Tel: (02) Fax: (02) Instructor: Nam-Hoi, Park Date: / / Ch.7 트러스 (Truss) * 트러스의분류 트러스 ( 차원 ): 1. 평면트러스 (planar tru
 STATICS Page: 7-1 Instructor: Nam-Hoi, Park Date: / / Ch.7 트러스 (Truss) * 트러스의분류 트러스 ( 차원 ): 1. 평면트러스 (planar truss) - 2 차원 2. 공간트러스 or 입체트러스 (space truss)-3 차원트러스 ( 형태 ): 1. 단순트러스 (simple truss) 삼각형형태의트러스
STATICS Page: 7-1 Instructor: Nam-Hoi, Park Date: / / Ch.7 트러스 (Truss) * 트러스의분류 트러스 ( 차원 ): 1. 평면트러스 (planar truss) - 2 차원 2. 공간트러스 or 입체트러스 (space truss)-3 차원트러스 ( 형태 ): 1. 단순트러스 (simple truss) 삼각형형태의트러스
Journal of Life Science 2011, Vol. 21. No μ μ
 Journal of Life Science 2011 Vol. 21. No. 8. 1120~1126 ISSN : 1225-9918 DOI : http://dx.doi.org/10.5352/jls.2011.21.8.1120 μ μ μ α β Journal of Life Science 2011, Vol. 21. No. 8 1121 μ μ 1122 생명과학회지 2011,
Journal of Life Science 2011 Vol. 21. No. 8. 1120~1126 ISSN : 1225-9918 DOI : http://dx.doi.org/10.5352/jls.2011.21.8.1120 μ μ μ α β Journal of Life Science 2011, Vol. 21. No. 8 1121 μ μ 1122 생명과학회지 2011,
본 발명은 난연재료 조성물에 관한 것으로, 보다 상세하게는 케이블이나 전선의 시스체로 쓰이는 저발연, 저독성을 가진 열가소성 난연재료 조성물에 관한 것이다. 종래의 선박용 케이블은 그 사용 용도와 장소에 따라 다양한 제품들로 구별된다. 근래 들어 해양 구조물 및 선박에
 (51) Int. Cl. 7 C08L 31/04 (19)대한민국특허청(KR) (12) 등록특허공보(B1) (45) 공고일자 (11) 등록번호 (24) 등록일자 2005년03월08일 10-0473564 2005년02월17일 (21) 출원번호 10-2001-0074372 (65) 공개번호 10-2003-0043291 (22) 출원일자 2001년11월27일 (43)
(51) Int. Cl. 7 C08L 31/04 (19)대한민국특허청(KR) (12) 등록특허공보(B1) (45) 공고일자 (11) 등록번호 (24) 등록일자 2005년03월08일 10-0473564 2005년02월17일 (21) 출원번호 10-2001-0074372 (65) 공개번호 10-2003-0043291 (22) 출원일자 2001년11월27일 (43)
(72) 발명자 정종수 서울특별시 서대문구 모래내로 319, 101동 405호 (홍은동, 진흥아파트) 김정환 서울특별시 구로구 구로동로21길 7 (구로동) - 2 -
 (19) 대한민국특허청(KR) (12) 등록특허공보(B1) (51) 국제특허분류(Int. Cl.) B01J 23/34 (2006.01) B01J 37/02 (2006.01) B01J 37/08 (2006.01) B01D 53/86 (2006.01) (21) 출원번호 10-2010-0098306 (22) 출원일자 2010년10월08일 심사청구일자 2010년10월08일
(19) 대한민국특허청(KR) (12) 등록특허공보(B1) (51) 국제특허분류(Int. Cl.) B01J 23/34 (2006.01) B01J 37/02 (2006.01) B01J 37/08 (2006.01) B01D 53/86 (2006.01) (21) 출원번호 10-2010-0098306 (22) 출원일자 2010년10월08일 심사청구일자 2010년10월08일
특허청구의 범위 청구항 1 뉴클레오사이드, 뉴클레오사이드 역전사효소 억제제, 비-뉴클레오사이드 역전사효소 억제제, 프로테아제 억제제, 아만타딘, 리만타딘, 자나미비르 및 오셀타미비르로 이루어진 그룹 중에서 선택된 항-바이러스제에 작 동적으로 부착된 아미노인지질에 결합하
 (51) Int. Cl. (19) 대한민국특허청(KR) (12) 등록특허공보(B1) A61K 39/395 (2006.01) A61K 39/42 (2006.01) A61K 38/17 (2006.01) (21) 출원번호 10-2005-7000602 (22) 출원일자(국제출원일자) 2003년07월15일 심사청구일자 2008년07월07일 (85) 번역문제출일자 2005년01월12일
(51) Int. Cl. (19) 대한민국특허청(KR) (12) 등록특허공보(B1) A61K 39/395 (2006.01) A61K 39/42 (2006.01) A61K 38/17 (2006.01) (21) 출원번호 10-2005-7000602 (22) 출원일자(국제출원일자) 2003년07월15일 심사청구일자 2008년07월07일 (85) 번역문제출일자 2005년01월12일
<5BC7D0B1B3BAB8B0C7C1F8C8EFBFF85D B3E2B5B520C1A63437C8A320C7D0B1B3BAB8B0C7BFACBAB85FB3BBC1F62E687770>
 발 간 등 록 번 호 51-7010031-000001-10 년도 2 0 1 7 제 호 학교보건연보 47 2017년도 제47호 학교보건연보 http://www.bogun.seoul.kr 서울특별시교육청학교보건진흥원 서울특별시교육청학교보건진흥원 http://www.bogun.seoul.kr 발간등록번호 51-7010031-000001-10 2017 년도 제 47
발 간 등 록 번 호 51-7010031-000001-10 년도 2 0 1 7 제 호 학교보건연보 47 2017년도 제47호 학교보건연보 http://www.bogun.seoul.kr 서울특별시교육청학교보건진흥원 서울특별시교육청학교보건진흥원 http://www.bogun.seoul.kr 발간등록번호 51-7010031-000001-10 2017 년도 제 47
실용신안 등록청구의 범위 청구항 1 톤백마대가 설치될 수 있도록 일정간격을 두고 설치되는 한 쌍의 지지프레임과, 상기 지지프레임과 지지프레임의 상부를 서로 연결하는 한 쌍의 연결프레임과, 상기 연결프레임의 상부에 일정간격을 두고 다수 설치되어 상기 톤백마대와 그 투입구
 (19) 대한민국특허청(KR) (12) 공개실용신안공보(U) (51) 국제특허분류(Int. Cl.) B65B 67/12 (2006.01) B65D 88/16 (2006.01) (21) 출원번호 20-2012-0003587 (22) 출원일자 2012년05월01일 심사청구일자 2012년05월01일 (11) 공개번호 20-2013-0006479 (43) 공개일자
(19) 대한민국특허청(KR) (12) 공개실용신안공보(U) (51) 국제특허분류(Int. Cl.) B65B 67/12 (2006.01) B65D 88/16 (2006.01) (21) 출원번호 20-2012-0003587 (22) 출원일자 2012년05월01일 심사청구일자 2012년05월01일 (11) 공개번호 20-2013-0006479 (43) 공개일자
암센터뉴스레터1
 CANCER HOSPITAL News News Letter For Yonsei University Gangnam Severance Hospital http://gs.iseverance.com 2012.06.21 2012.08.16 2012.09.19 2012.10.04 2012.10.25 CONTENTS 2012.07.27 2012.10.06 2012.11.06
CANCER HOSPITAL News News Letter For Yonsei University Gangnam Severance Hospital http://gs.iseverance.com 2012.06.21 2012.08.16 2012.09.19 2012.10.04 2012.10.25 CONTENTS 2012.07.27 2012.10.06 2012.11.06
2018 년건강기능식품 상시적재평가결과보고서 < 글루코사민, 비타민 D, 프락토올리고당, 쏘팔메토열매추출물, EPA 및 DHA 함유유지, 백수오등복합추출물, 헛개나무과병추출분말 >
 2018 년건강기능식품 상시적재평가결과보고서 < 글루코사민, 비타민 D, 프락토올리고당, 쏘팔메토열매추출물, EPA 및 DHA 함유유지, 백수오등복합추출물, 헛개나무과병추출분말 > 본보고서는 2018년상시적재평가기능성원료 7종에대한재평가보고서입니다. 보고서의평가결과는 건강기능식품의기준및규격 과 건강기능식품기능성원료및기준 규격인정에관한규정 에따라인정사항변경이이루어질예정이며,
2018 년건강기능식품 상시적재평가결과보고서 < 글루코사민, 비타민 D, 프락토올리고당, 쏘팔메토열매추출물, EPA 및 DHA 함유유지, 백수오등복합추출물, 헛개나무과병추출분말 > 본보고서는 2018년상시적재평가기능성원료 7종에대한재평가보고서입니다. 보고서의평가결과는 건강기능식품의기준및규격 과 건강기능식품기능성원료및기준 규격인정에관한규정 에따라인정사항변경이이루어질예정이며,
¹ÙÀÌ¿À´Ï¾È½º03
 http://biosys.kaist.ac.kr NO. 03 2008 KAIST Department of Bio and Brain Engineering Newsletter Contents 02 04 06 10 12 13 20 22 23 Bio and Brain Engineering 2 _Department of Bio and Brain Engineering Newsletter
http://biosys.kaist.ac.kr NO. 03 2008 KAIST Department of Bio and Brain Engineering Newsletter Contents 02 04 06 10 12 13 20 22 23 Bio and Brain Engineering 2 _Department of Bio and Brain Engineering Newsletter
특허청구의 범위 청구항 1 제1 내지 제6 암이 각각의 관절부를 가지며 형성되며, 상기 제1 내지 제6 암 각각은 제1 내지 제6 링크에 의해 링크되고, 상기 제1 내지 제6 암 내부에는 각각의 암을 구동하는 구동모듈이 각각 내장되며, 상기 구동모듈 각각의 선단에는 1
 (19) 대한민국특허청(KR) (12) 등록특허공보(B1) (51) 국제특허분류(Int. Cl.) B25J 9/06 (2006.01) B25J 19/02 (2006.01) (21) 출원번호 10-2011-0079361 (22) 출원일자 2011년08월10일 심사청구일자 2011년08월10일 (65) 공개번호 10-2013-0017122 (43) 공개일자 2013년02월20일
(19) 대한민국특허청(KR) (12) 등록특허공보(B1) (51) 국제특허분류(Int. Cl.) B25J 9/06 (2006.01) B25J 19/02 (2006.01) (21) 출원번호 10-2011-0079361 (22) 출원일자 2011년08월10일 심사청구일자 2011년08월10일 (65) 공개번호 10-2013-0017122 (43) 공개일자 2013년02월20일
특허청구의 범위 청구항 1 화학식 I의 화합물, 또는 그의 거울상이성질체, 부분입체이성질체, 용매화물, 염 또는 전구약물. <화학식 I> W-L-Z 식 중, W는 아릴, 시클로알킬, 헤테로아릴 또는 헤테로시클릴이며, 이들 모두는 R 1, R 1a, R 1b, R 1c
 (19) 대한민국특허청(KR) (12) 공개특허공보(A) (11) 공개번호 10-2008-0018942 (43) 공개일자 2008년02월28일 (51) Int. Cl. C07D 471/04 (2006.01) A61K 31/437 (2006.01) A61P 3/10 (2006.01) (21) 출원번호 10-2008-7000470 (22) 출원일자 2008년01월08일
(19) 대한민국특허청(KR) (12) 공개특허공보(A) (11) 공개번호 10-2008-0018942 (43) 공개일자 2008년02월28일 (51) Int. Cl. C07D 471/04 (2006.01) A61K 31/437 (2006.01) A61P 3/10 (2006.01) (21) 출원번호 10-2008-7000470 (22) 출원일자 2008년01월08일
<4D F736F F F696E74202D20322DC0AFC0FCC0DAB9DFC7F6C0C7C1B6C0FD205BC8A3C8AF20B8F0B5E55D>
 주제 2. 유전자발현의조절 생명과학 11 장앞부분 Figure 06.01: The minimum gene number required for any type of organism increases with its complexity. 1 인간게놈 DNA 중 : 유전자 ( 엑손 + 인트론 ): 25% 엑손 : 1%, 인트론 : 24% 나머지는유전자가아닌 DNA
주제 2. 유전자발현의조절 생명과학 11 장앞부분 Figure 06.01: The minimum gene number required for any type of organism increases with its complexity. 1 인간게놈 DNA 중 : 유전자 ( 엑손 + 인트론 ): 25% 엑손 : 1%, 인트론 : 24% 나머지는유전자가아닌 DNA
 Ⅰ. 석면 1 1) American Geological Institute, Glossary of geology, 2008, http://glossary.agiweb.org 2) US OSHA standard 29CFR1910.1001(b) 2 석면분석전문가양성교육교재 : 편광현미경을이용한고형시료중석면분석 1) Cornelis Klein, The Manual
Ⅰ. 석면 1 1) American Geological Institute, Glossary of geology, 2008, http://glossary.agiweb.org 2) US OSHA standard 29CFR1910.1001(b) 2 석면분석전문가양성교육교재 : 편광현미경을이용한고형시료중석면분석 1) Cornelis Klein, The Manual
Chap 6: Graphs
 그래프표현법 인접행렬 (Adjacency Matrix) 인접리스트 (Adjacency List) 인접다중리스트 (Adjacency Multilist) 6 장. 그래프 (Page ) 인접행렬 (Adjacency Matrix) n 개의 vertex 를갖는그래프 G 의인접행렬의구성 A[n][n] (u, v) E(G) 이면, A[u][v] = Otherwise, A[u][v]
그래프표현법 인접행렬 (Adjacency Matrix) 인접리스트 (Adjacency List) 인접다중리스트 (Adjacency Multilist) 6 장. 그래프 (Page ) 인접행렬 (Adjacency Matrix) n 개의 vertex 를갖는그래프 G 의인접행렬의구성 A[n][n] (u, v) E(G) 이면, A[u][v] = Otherwise, A[u][v]
(72) 발명자 토키, 브라이언, 이. 미국 워싱턴주쇼어라인 27 번애비뉴엔이 에번스, 알렌, 제이. 미국 캘리포니아주샌카를로스어로이요애비뉴 1932 클라인, 토니, 베스 미국 워싱턴주시애틀 6 번애비뉴웨스트 3629 폴라키스
 (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (45) 공고일자 2012년10월18일 (11) 등록번호 10-1192496 (24) 등록일자 2012년10월11일 (51) 국제특허분류 (Int. Cl.) C07D 207/08 (2006.01) A61K 38/00 (2006.01) A61P 35/00 (2006.01) A61P 37/00 (2006.01)
(19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) (45) 공고일자 2012년10월18일 (11) 등록번호 10-1192496 (24) 등록일자 2012년10월11일 (51) 국제특허분류 (Int. Cl.) C07D 207/08 (2006.01) A61K 38/00 (2006.01) A61P 35/00 (2006.01) A61P 37/00 (2006.01)
<4D F736F F F696E74202D20312DC0AFC0FCC0DAC0C7BAD0C0DABBFDB9B0C7D0205BC8A3C8AF20B8F0B5E55D>
 주제 (1) 유전자의분자생물학 생명과학 : 개념과현상의이해 9 판 (Pearson) 10 장 유전물질의구조 : 1~3 DN 복제 : 4~5 DN 에서 RN 로그리고단백질로의유전정보의흐름 : 6~15 겸상적혈구빈혈증 ( 낫모양적혈구빈혈증 ) 1 21 삼염색체성 21 삼염색체성 ( 다운증후군 ) 그림암세포발달중의돌연변이축적과정 2 그림 1.2_1 그림 1.2_2
주제 (1) 유전자의분자생물학 생명과학 : 개념과현상의이해 9 판 (Pearson) 10 장 유전물질의구조 : 1~3 DN 복제 : 4~5 DN 에서 RN 로그리고단백질로의유전정보의흐름 : 6~15 겸상적혈구빈혈증 ( 낫모양적혈구빈혈증 ) 1 21 삼염색체성 21 삼염색체성 ( 다운증후군 ) 그림암세포발달중의돌연변이축적과정 2 그림 1.2_1 그림 1.2_2
SM-G906S 갤럭시 S5 광대역 LTE-A O SM-G910S 갤럭시라운드 O SM-G920S 갤럭시 S O SM-G925S 갤럭시 S6 엣지 O SM-G928S 갤럭시 S6 엣지 plus O SM-G930S
 제품의사양을보여주는표입니다. 제조사 기종 이름 버전 944( 인증 ) SHV-E110S 갤럭시 S2 LTE 4.1.2 O SHV-E120S 갤럭시 S2 HD LTE 4.0.4 O SHV-E160S 갤럭시노트1 4.1.2 O SHV-E170S 갤럭시 R 스타일 4.1.2 O SHV-E210S 갤럭시 S3 LTE 4.4.4 O SHV-E220S 갤럭시팝 4.4.4
제품의사양을보여주는표입니다. 제조사 기종 이름 버전 944( 인증 ) SHV-E110S 갤럭시 S2 LTE 4.1.2 O SHV-E120S 갤럭시 S2 HD LTE 4.0.4 O SHV-E160S 갤럭시노트1 4.1.2 O SHV-E170S 갤럭시 R 스타일 4.1.2 O SHV-E210S 갤럭시 S3 LTE 4.4.4 O SHV-E220S 갤럭시팝 4.4.4
(52) CPC 특허분류 C07C 235/32 ( ) - 2 -
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) C07C 231/12 (2006.01) A61K 49/04 (2006.01) C07C 235/32 (2006.01) (52) CPC 특허분류 C07C 231/12 (2013.01) A61K 49/04 (2013.01) (21) 출원번호 10-2015-7011933
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) C07C 231/12 (2006.01) A61K 49/04 (2006.01) C07C 235/32 (2006.01) (52) CPC 특허분류 C07C 231/12 (2013.01) A61K 49/04 (2013.01) (21) 출원번호 10-2015-7011933
Microsoft Word - 4.하이드로젤용 고분자(합성고분자1)_ docx
 2.2 합성고분자 2.2.1 Poly(acrylic acid) 합성고분자를기반으로하는대표적하이드로젤중의하나는 poly(2-hydroxyethylmethacrylate) (HEMA) 이다. Poly(HEMA) 는콘텍트렌즈를포함하여안과용으로자주사용되고있다. Poly(HEMA) 는반복동결 / 해동또는미립자침출법에의하여연골재생을위한미세다공성하이드로젤을제조할수있다 [1].
2.2 합성고분자 2.2.1 Poly(acrylic acid) 합성고분자를기반으로하는대표적하이드로젤중의하나는 poly(2-hydroxyethylmethacrylate) (HEMA) 이다. Poly(HEMA) 는콘텍트렌즈를포함하여안과용으로자주사용되고있다. Poly(HEMA) 는반복동결 / 해동또는미립자침출법에의하여연골재생을위한미세다공성하이드로젤을제조할수있다 [1].
 ('08) 0.7% ('09) 0.6% ('0) 0.5% (') 0.3% ('08) 0.05% ('09) 0.07% ('0) 0.07% (') 0.09% ('08) 0.80% ('09) 0.49% ('0) 0.43% (') 0.26% (: ) 기관 축종 모니터링 물질명 농도 규제검사 물질명 농도 (ppm) 계 ( 두 ) 세파로니움 ( 신장 )
('08) 0.7% ('09) 0.6% ('0) 0.5% (') 0.3% ('08) 0.05% ('09) 0.07% ('0) 0.07% (') 0.09% ('08) 0.80% ('09) 0.49% ('0) 0.43% (') 0.26% (: ) 기관 축종 모니터링 물질명 농도 규제검사 물질명 농도 (ppm) 계 ( 두 ) 세파로니움 ( 신장 )
IMPAIRED INTRAMEMBRANOUS BONE FORMATION FOLLOWING BONE MARROW ABLATION IN THE ABSENCE OF TNFa SIGNALING
 골이형성증 서울대학교어린이병원 소아정형외과 조태준 2012 KPOS ICL 1 골이형성증 유전자결함으로비정상적인골 - 연골성장을보이는다양한질환군 - 50 ~ 70: 증상, Xray, 유전양상연구 - 80: 자연경과, 진단명세분화 - 90 이후 : 유전자변이및병리기전연구 2012 KPOS ICL 2 흔한정형외과문제들 단신 ( 왜소증 ) 2012 KPOS ICL
골이형성증 서울대학교어린이병원 소아정형외과 조태준 2012 KPOS ICL 1 골이형성증 유전자결함으로비정상적인골 - 연골성장을보이는다양한질환군 - 50 ~ 70: 증상, Xray, 유전양상연구 - 80: 자연경과, 진단명세분화 - 90 이후 : 유전자변이및병리기전연구 2012 KPOS ICL 2 흔한정형외과문제들 단신 ( 왜소증 ) 2012 KPOS ICL
Microsoft PowerPoint - 김미영
 암세포의위험한여행 한국과학기술원 김미영 강의개요 전이란무엇인가? 전이는어떤과정을통해진행될까? 전이예측방법은어떤것들이있을까? Cancer ( 악성종양 ) US South Korea 질병사망률질병사망률 1. 심장병 26% 1. Cancer 26.7% 2. Cancer 23% 2. 뇌출혈 12.7% 3. 뇌출혈 5.6% 3. 심장병 7.9% >20,000 환자가악성종양에의해매일사망함
암세포의위험한여행 한국과학기술원 김미영 강의개요 전이란무엇인가? 전이는어떤과정을통해진행될까? 전이예측방법은어떤것들이있을까? Cancer ( 악성종양 ) US South Korea 질병사망률질병사망률 1. 심장병 26% 1. Cancer 26.7% 2. Cancer 23% 2. 뇌출혈 12.7% 3. 뇌출혈 5.6% 3. 심장병 7.9% >20,000 환자가악성종양에의해매일사망함
바이오인소개_알테오젠_150609.hwp
 1 생명공학정책연구센터 기 업 소 개 http://www.bioin.or.kr Bioin사이트에서는 Bio기업의 소개자료가 홍보 제공됩니다. 문의 : 생명공학정책연구센터 박성훈, 우창우 연구원(042-879-8377, 8382) BT 기업 기본 Profile 내 용 비 고 기업명 주식회사 알테오젠 기업 로고 기업분류 벤처기업 대표이사 박순재 설립일 2008년
1 생명공학정책연구센터 기 업 소 개 http://www.bioin.or.kr Bioin사이트에서는 Bio기업의 소개자료가 홍보 제공됩니다. 문의 : 생명공학정책연구센터 박성훈, 우창우 연구원(042-879-8377, 8382) BT 기업 기본 Profile 내 용 비 고 기업명 주식회사 알테오젠 기업 로고 기업분류 벤처기업 대표이사 박순재 설립일 2008년
등록특허 (51) Int. Cl. (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) C12N 15/40 ( ) (21) 출원번호 (22) 출원일자 2002 년 04 월 04 일 심사청구일자 2007
 (51) Int. Cl. (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) C12N 15/40 (2006.01) (21) 출원번호 10-2003-7013021 (22) 출원일자 2002 년 04 월 04 일 심사청구일자 2007 년 03 월 29 일 (85) 번역문제출일자 2003 년 10 월 02 일 (65) 공개번호 10-2003-0092051
(51) Int. Cl. (19) 대한민국특허청 (KR) (12) 등록특허공보 (B1) C12N 15/40 (2006.01) (21) 출원번호 10-2003-7013021 (22) 출원일자 2002 년 04 월 04 일 심사청구일자 2007 년 03 월 29 일 (85) 번역문제출일자 2003 년 10 월 02 일 (65) 공개번호 10-2003-0092051
농림축산식품부장관귀하 본보고서를 미생물을활용한친환경작물보호제및비료의제형화와현장적용매뉴 얼개발 ( 개발기간 : ~ ) 과제의최종보고서로제출합니다 주관연구기관명 : 고려바이오주식회사 ( 대표자 ) 김영권 (
 농림축산식품부장관귀하 본보고서를 미생물을활용한친환경작물보호제및비료의제형화와현장적용매뉴 얼개발 ( 개발기간 :2014. 7. 29 ~ 2016. 7. 28.) 과제의최종보고서로제출합니다. 2016. 7. 28. 주관연구기관명 : 고려바이오주식회사 ( 대표자 ) 김영권 ( 인 ) 협동연구기관명 : 목원대학교산학협력단 ( 대표자 ) 고대식 ( 인 ) 협동연구기관명
농림축산식품부장관귀하 본보고서를 미생물을활용한친환경작물보호제및비료의제형화와현장적용매뉴 얼개발 ( 개발기간 :2014. 7. 29 ~ 2016. 7. 28.) 과제의최종보고서로제출합니다. 2016. 7. 28. 주관연구기관명 : 고려바이오주식회사 ( 대표자 ) 김영권 ( 인 ) 협동연구기관명 : 목원대학교산학협력단 ( 대표자 ) 고대식 ( 인 ) 협동연구기관명
PowerPoint 프레젠테이션
 Glutathione Excellose handbook - Purification of GST fusion proteins - Looking for more detail Purification protocol? - Glutathione Excellose Spin Kit - Glutathione MiniExcellose - Glutathione Excellose
Glutathione Excellose handbook - Purification of GST fusion proteins - Looking for more detail Purification protocol? - Glutathione Excellose Spin Kit - Glutathione MiniExcellose - Glutathione Excellose
J KSM ISSN J Korean Soc Menopause 2013;19: Original Article 폐경여성에서호르몬치료에따른골밀도변화의상호관계 정수호
 ISSN 1226-8704 Original Article 폐경여성에서호르몬치료에따른골밀도변화의상호관계 정수호 1 김태희 1 이해혁 1 박준식 1 상재홍 2 1 순천향대학교부속부천병원산부인과, 2 구미병원산부인과 Hormone Therapy in Postmenopausal Women According to the Correlation of Changes in
ISSN 1226-8704 Original Article 폐경여성에서호르몬치료에따른골밀도변화의상호관계 정수호 1 김태희 1 이해혁 1 박준식 1 상재홍 2 1 순천향대학교부속부천병원산부인과, 2 구미병원산부인과 Hormone Therapy in Postmenopausal Women According to the Correlation of Changes in
최민지 / 세계무역기구과 / :16:24-2 -
 - 2 - - 3 - - 4 - - 5 - - 6 - - 7 - - 8 - - 9 - - 10 - - 11 - - 12 - - 13 - - 14 - - 15 - - 16 - - 17 - - 18 - 안식향산안식향산나트륨안식향산칼륨안식향산칼슘 파라옥시안식향산메틸파라옥시안식향산에틸 0.6 이하 ( 안식향산으로서, 파라옥시안식향산에틸또는파라옥시안식향산메틸과병용할때에는안식향산으로서사용량과파라옥시안식향산으로서사용량의합계가
- 2 - - 3 - - 4 - - 5 - - 6 - - 7 - - 8 - - 9 - - 10 - - 11 - - 12 - - 13 - - 14 - - 15 - - 16 - - 17 - - 18 - 안식향산안식향산나트륨안식향산칼륨안식향산칼슘 파라옥시안식향산메틸파라옥시안식향산에틸 0.6 이하 ( 안식향산으로서, 파라옥시안식향산에틸또는파라옥시안식향산메틸과병용할때에는안식향산으로서사용량과파라옥시안식향산으로서사용량의합계가
소아일반영상의학검사에서의 환자선량권고량가이드라인 - 두부, 복부, 골반 -
 소아일반영상의학검사에서의환자선량권고량가이드라인 - 두부, 복부, 골반 - 소아일반영상의학검사에서의 환자선량권고량가이드라인 - 두부, 복부, 골반 - Ⅰ. 서언 1 2 Ⅱ. 의료피폭에서의방사선방어 1 1990 ICRP 권고에따른방사선방어의원리 3 2 2007 ICRP 신권고에따른방사선방어의원리 4 3 환자선량권고량 (Diagnostic Reference Level)
소아일반영상의학검사에서의환자선량권고량가이드라인 - 두부, 복부, 골반 - 소아일반영상의학검사에서의 환자선량권고량가이드라인 - 두부, 복부, 골반 - Ⅰ. 서언 1 2 Ⅱ. 의료피폭에서의방사선방어 1 1990 ICRP 권고에따른방사선방어의원리 3 2 2007 ICRP 신권고에따른방사선방어의원리 4 3 환자선량권고량 (Diagnostic Reference Level)
(52) CPC 특허분류 C12N 15/70 ( ) C12N 15/74 ( ) C12P 7/6409 ( ) (72) 발명자 워너, 조셉, 알. 미국 캘리포니아주산클레멘테비스타마리나 258 루이, 마이클 미국 콜로라도
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) C12N 15/63 (2006.01) C12N 15/52 (2006.01) C12N 15/70 (2006.01) C12N 15/74 (2006.01) (52) CPC 특허분류 C12N 15/63 (2013.01) C12N 15/52 (2013.01) (21)
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) C12N 15/63 (2006.01) C12N 15/52 (2006.01) C12N 15/70 (2006.01) C12N 15/74 (2006.01) (52) CPC 특허분류 C12N 15/63 (2013.01) C12N 15/52 (2013.01) (21)
Janeway's Immunology
 Chapter 3 B 세포및 T 세포수용체의 항원인식 2014 년도 2 학기약품면역학제 5 강 (1/50) B 세포수용체 수용체 (receptor)- 리간드 (ligand) 적응면역 (adaptive immunity) 면역글로불린 (immunoglobulin, Ig) B cell receptor Membrane-bound immunoglobulin B 세포의항원인식분자
Chapter 3 B 세포및 T 세포수용체의 항원인식 2014 년도 2 학기약품면역학제 5 강 (1/50) B 세포수용체 수용체 (receptor)- 리간드 (ligand) 적응면역 (adaptive immunity) 면역글로불린 (immunoglobulin, Ig) B cell receptor Membrane-bound immunoglobulin B 세포의항원인식분자
 연구보고서 2009-05 일반화선형모형 (GLM) 을이용한 자동차보험요율상대도산출방법연구 Ⅰ. 요율상대도산출시일반화선형모형활용방법 1. 일반화선형모형 2 연구보고서 2009-05 2. 일반화선형모형의자동차보험요율산출에적용방법 요약 3 4 연구보고서 2009-05 Ⅱ. 일반화선형모형을이용한실증분석 1. 모형적용기준 < > = 요약 5 2. 통계자료및통계모형
연구보고서 2009-05 일반화선형모형 (GLM) 을이용한 자동차보험요율상대도산출방법연구 Ⅰ. 요율상대도산출시일반화선형모형활용방법 1. 일반화선형모형 2 연구보고서 2009-05 2. 일반화선형모형의자동차보험요율산출에적용방법 요약 3 4 연구보고서 2009-05 Ⅱ. 일반화선형모형을이용한실증분석 1. 모형적용기준 < > = 요약 5 2. 통계자료및통계모형
248019_ALIS0052.hwp
 Generation history for optimization eneration history of optimization 불평형질량 편심량 회전수 축외경 축내경 축길이 베어링간격위치 베어링강성 교배 대상이되는개체의수 집단의크기 돌연변이 대상이되는유전자수 집단내전체유전자수 와 와 Generation history
Generation history for optimization eneration history of optimization 불평형질량 편심량 회전수 축외경 축내경 축길이 베어링간격위치 베어링강성 교배 대상이되는개체의수 집단의크기 돌연변이 대상이되는유전자수 집단내전체유전자수 와 와 Generation history
Microsoft PowerPoint - Chapter 3-2
 Chapter 3 단백질의탐구및단백체학 (3) 겔거르기 (Gel filtration) chromatography: 크기에의한분리 - Resin: 다공성구슬 = Sephadex, Sepharose, Biogel = Bead size: 100 mm - 원리 : 분배 (partition) chromatograph = 분배 : 용질이이동상 (mobile phase)
Chapter 3 단백질의탐구및단백체학 (3) 겔거르기 (Gel filtration) chromatography: 크기에의한분리 - Resin: 다공성구슬 = Sephadex, Sepharose, Biogel = Bead size: 100 mm - 원리 : 분배 (partition) chromatograph = 분배 : 용질이이동상 (mobile phase)
Microsoft PowerPoint 산업전망_통장전부_v9.pptx
 Contents 3 4 5 6 7 8 9 10 11 12 13 14 주 : Murata 는 3 월 31 일결산, Chiyoda Integre 는 8 월 31 일결산자료 : Bloomberg, 미래에셋대우리서치센터 15 자료 : Bloomberg, 미래에셋대우리서치센터 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32
Contents 3 4 5 6 7 8 9 10 11 12 13 14 주 : Murata 는 3 월 31 일결산, Chiyoda Integre 는 8 월 31 일결산자료 : Bloomberg, 미래에셋대우리서치센터 15 자료 : Bloomberg, 미래에셋대우리서치센터 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32
PowerPoint Presentation
 4 장 : 인간뼈의성장과발달의 운동역학 The Biomechanics of Human Bone Growth and Development 학습목표 뼈의구성물질과구조가어떻게역학적부하에견디는지설명할수있다. 뼈의성장과성숙과정을기술할수있다. 운동과무중력환경이뼈의미네랄 (mineralization ) 에미치는영향을기술할수있다. 골다공증의중요성과예방에대한최근이론을논의할수있다.
4 장 : 인간뼈의성장과발달의 운동역학 The Biomechanics of Human Bone Growth and Development 학습목표 뼈의구성물질과구조가어떻게역학적부하에견디는지설명할수있다. 뼈의성장과성숙과정을기술할수있다. 운동과무중력환경이뼈의미네랄 (mineralization ) 에미치는영향을기술할수있다. 골다공증의중요성과예방에대한최근이론을논의할수있다.
<30322EBFC0BCF6BFB52E687770>
 성염색체 이상의 산전 상담 성균관대학교 의과대학 삼성서울병원 산부인과 오 수 영 Soo-Young Oh, M.D., Ph.D. Department of Obstetrics and Gynecology, Samsung Medical Center, Sungkyunkwan University School of Medicine, Seoul, Korea 1서 성염색체이상은
성염색체 이상의 산전 상담 성균관대학교 의과대학 삼성서울병원 산부인과 오 수 영 Soo-Young Oh, M.D., Ph.D. Department of Obstetrics and Gynecology, Samsung Medical Center, Sungkyunkwan University School of Medicine, Seoul, Korea 1서 성염색체이상은
Chapter 6. Nucleotides and Nucleic Acids 세포대사에서뉴클레오타이드 (nucleotide) 의기능은무엇인가? Objective 유전체학 (genomics) 과단백체학 (proteomics) 기본개념이해 재조합 DNA 기술 (recombin
 Chapter 6. Nucleotides and Nucleic Acids 세포대사에서뉴클레오타이드 (nucleotide) 의기능은무엇인가? Objective 유전체학 (genomics) 과단백체학 (proteomics) 기본개념이해 재조합 DNA 기술 (recombinant DNA technology) 란? - 효소의보조인자, 대사중간산물구성성분, 유전정보함유등
Chapter 6. Nucleotides and Nucleic Acids 세포대사에서뉴클레오타이드 (nucleotide) 의기능은무엇인가? Objective 유전체학 (genomics) 과단백체학 (proteomics) 기본개념이해 재조합 DNA 기술 (recombinant DNA technology) 란? - 효소의보조인자, 대사중간산물구성성분, 유전정보함유등
본연구는 mabs 와 ADC 의 LC/MS 분석을증명하기위해폴리머역상컬럼 (Agilent PLRP-S) 을사용했습니다. PLRP-S 컬럼은폴리스티렌및디비닐벤젠으로만든단단하고큰다공성구형입자로채워집니다. 이러한입자들은전체 ph 범위에서물리화학적으로안정적입니다. 이입자들은본
 mabs 및 ADC 의 LC/MS 분리를위한 PLRP-S 폴리머역상컬럼 Intact mabs, 조각 mabs 및 ADC 의분석 응용자료 생물약제및생물의약품 저자 Suresh Babu C.V. Agilent Technologies, Inc. 개요 이응용자료는단일클론항체 (mabs) 및항체약물결합체 (ADC) 와같은대형생체분자의특성규명을위한폴리머기반역상컬럼의응용기술을기술하고있습니다.
mabs 및 ADC 의 LC/MS 분리를위한 PLRP-S 폴리머역상컬럼 Intact mabs, 조각 mabs 및 ADC 의분석 응용자료 생물약제및생물의약품 저자 Suresh Babu C.V. Agilent Technologies, Inc. 개요 이응용자료는단일클론항체 (mabs) 및항체약물결합체 (ADC) 와같은대형생체분자의특성규명을위한폴리머기반역상컬럼의응용기술을기술하고있습니다.
Art & Technology #5: 3D 프린팅 - Art World | 현대자동차
 Art & Technology #5: 3D 프린팅 새로운 기술, 새로운 가능성 미래를 바꿔놓을 기술 이 무엇인 것 같으냐고 묻는다면 어떻게 대답해야 할까요? 답은 한 마치 한 쌍(pair)과도 같은 3D 스캐닝-프린팅 산업이 빠른 속도로 진화하고 있는 이유입니 가지는 아닐 것이나 그 대표적인 기술로 3D 스캐닝 과 3D 프린팅 을 들 수 있을 것입니 다. 카메라의
Art & Technology #5: 3D 프린팅 새로운 기술, 새로운 가능성 미래를 바꿔놓을 기술 이 무엇인 것 같으냐고 묻는다면 어떻게 대답해야 할까요? 답은 한 마치 한 쌍(pair)과도 같은 3D 스캐닝-프린팅 산업이 빠른 속도로 진화하고 있는 이유입니 가지는 아닐 것이나 그 대표적인 기술로 3D 스캐닝 과 3D 프린팅 을 들 수 있을 것입니 다. 카메라의
저작자표시 - 비영리 - 변경금지 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원저작자를표시하여야합니다. 비영리. 귀하는이저작물을영리목적으로이용할
 저작자표시 - 비영리 - 변경금지 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원저작자를표시하여야합니다. 비영리. 귀하는이저작물을영리목적으로이용할수없습니다. 변경금지. 귀하는이저작물을개작, 변형또는가공할수없습니다. 귀하는, 이저작물의재이용이나배포의경우,
저작자표시 - 비영리 - 변경금지 2.0 대한민국 이용자는아래의조건을따르는경우에한하여자유롭게 이저작물을복제, 배포, 전송, 전시, 공연및방송할수있습니다. 다음과같은조건을따라야합니다 : 저작자표시. 귀하는원저작자를표시하여야합니다. 비영리. 귀하는이저작물을영리목적으로이용할수없습니다. 변경금지. 귀하는이저작물을개작, 변형또는가공할수없습니다. 귀하는, 이저작물의재이용이나배포의경우,
<30325F D C1F6BBF3B0ADC1C25FC1A4C8A3BFAC2E687770>
 대한내분비학회지 : 제 23권제 2 호 2008 10.3803/jkes.2008.23.2.76 지상강좌 골다공증진단및치료지침 2007 대한골대사학회지침위원회 정호연 Osteoporosis Diagnosis and Treatment 2007 Ho Yeon Chung Guideline Development Committee, Korean Society of Bone
대한내분비학회지 : 제 23권제 2 호 2008 10.3803/jkes.2008.23.2.76 지상강좌 골다공증진단및치료지침 2007 대한골대사학회지침위원회 정호연 Osteoporosis Diagnosis and Treatment 2007 Ho Yeon Chung Guideline Development Committee, Korean Society of Bone
(52) CPC 특허분류 C07K 16/2827 ( ) A61K 2039/505 ( ) A61K 2039/507 ( ) (72) 발명자 치우, 헨리 미국 캘리포니아샌프란시스코 20 번애비뉴 2334 레하르, 소피, 엠. 미국
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) C07K 16/28 (2006.01) A61K 39/00 (2006.01) A61K 39/395 (2006.01) (52) CPC 특허분류 C07K 16/28 (2013.01) A61K 39/3955 (2013.01) (21) 출원번호 10-2017-7026686(
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) C07K 16/28 (2006.01) A61K 39/00 (2006.01) A61K 39/395 (2006.01) (52) CPC 특허분류 C07K 16/28 (2013.01) A61K 39/3955 (2013.01) (21) 출원번호 10-2017-7026686(
Microsoft Word - 4장_처짐각법.doc
 동아대학교토목공학과구조역학 4. 처짐각법 변위법 (Slope Deflection ethod Displacement ethod) Objective of this chapter: 처짐각법의기본개념. What will be presented: 처짐각법을이용한다차부정정보해석 처짐각법을이용한다차부정정골조해석 Theoretical background 미국미네소타대학의
동아대학교토목공학과구조역학 4. 처짐각법 변위법 (Slope Deflection ethod Displacement ethod) Objective of this chapter: 처짐각법의기본개념. What will be presented: 처짐각법을이용한다차부정정보해석 처짐각법을이용한다차부정정골조해석 Theoretical background 미국미네소타대학의
- 2 -
 작품번호 37 Solar material 로쓰일수있는검정색물질의재발견! 출품분야학생부출품부문화학 2009. 5. 13 시 군 학교 ( 소속 ) 학년 ( 직위 ) 성 명 성남시풍생중학교 2 김호기, 이희원 지도교사풍생중학교교사김경원 - 1 - - 2 - - 3 - - 4 - - 5 - - 6 - - 7 - 석탄은주로탄소로구성되어있고, 수소와산소가들어있다. 이밖에질소
작품번호 37 Solar material 로쓰일수있는검정색물질의재발견! 출품분야학생부출품부문화학 2009. 5. 13 시 군 학교 ( 소속 ) 학년 ( 직위 ) 성 명 성남시풍생중학교 2 김호기, 이희원 지도교사풍생중학교교사김경원 - 1 - - 2 - - 3 - - 4 - - 5 - - 6 - - 7 - 석탄은주로탄소로구성되어있고, 수소와산소가들어있다. 이밖에질소
<4D F736F F F696E74202D20332DB5B9BFACBAAFC0CC2DB0A8BCF6BAD0BFAD2DBFB0BBF6C3BCC0CCBBF3205BC8A3C8AF20B8F0B5E55D>
 주제 3. 유전자돌연변이, 감수분열, 염색체이상 생명과학 10 장중간부분 생명과학 8 장뒷부분 유전체의 DNA 염기서열해독이끝난생물체와유전체크기, 유전자수 1 1. 돌연변이에의해유전정보가달라질수있다 돌연변이 (mutation) 란 DNA 의염기서열에변화가일어난것이다 돌연변이는 염색체상의넓은부위나 한개의뉴클레오티드에만생길수도있다 사람의경우, 생식세포 ( 정자,
주제 3. 유전자돌연변이, 감수분열, 염색체이상 생명과학 10 장중간부분 생명과학 8 장뒷부분 유전체의 DNA 염기서열해독이끝난생물체와유전체크기, 유전자수 1 1. 돌연변이에의해유전정보가달라질수있다 돌연변이 (mutation) 란 DNA 의염기서열에변화가일어난것이다 돌연변이는 염색체상의넓은부위나 한개의뉴클레오티드에만생길수도있다 사람의경우, 생식세포 ( 정자,
특허청구의 범위 청구항 1 앵커(20)를 이용한 옹벽 시공에 사용되는 옹벽패널에 있어서, 단위패널형태의 판 형태로 구성되며, 내부 중앙부가 후방 하부를 향해 기울어지도록 돌출 형성되어, 전면이 오 목하게 들어가고 후면이 돌출된 결속부(11)를 형성하되, 이 결속부(11
 (51) Int. Cl. (19) 대한민국특허청(KR) (12) 등록특허공보(B1) E02D 29/02 (2006.01) E02D 17/20 (2006.01) E02B 3/14 (2006.01) (21) 출원번호 10-2010-0089517 (22) 출원일자 2010년09월13일 심사청구일자 (56) 선행기술조사문헌 JP2006037700 A* KR100920461
(51) Int. Cl. (19) 대한민국특허청(KR) (12) 등록특허공보(B1) E02D 29/02 (2006.01) E02D 17/20 (2006.01) E02B 3/14 (2006.01) (21) 출원번호 10-2010-0089517 (22) 출원일자 2010년09월13일 심사청구일자 (56) 선행기술조사문헌 JP2006037700 A* KR100920461
<B1D9B0F1B0DDC7D02E687770>
 근골격학 (1) 차시수업계획서 대상본과 2 학년담당교수김백현 2015. 9. 23. 7 교시장소 1 의학관제 2 강의실 2. 수업주제 근골격계영상진단-관절염과무혈성괴사 1. Inflammatory와 degenerative arthritis를구분하고감별진단할수있어야한 다. 2. Rheumatoid arthritis, ankylosing spondylitis,
근골격학 (1) 차시수업계획서 대상본과 2 학년담당교수김백현 2015. 9. 23. 7 교시장소 1 의학관제 2 강의실 2. 수업주제 근골격계영상진단-관절염과무혈성괴사 1. Inflammatory와 degenerative arthritis를구분하고감별진단할수있어야한 다. 2. Rheumatoid arthritis, ankylosing spondylitis,
<3235B0AD20BCF6BFADC0C720B1D8C7D120C2FC20B0C5C1FE20322E687770>
 25 강. 수열의극한참거짓 2 두수열 { }, {b n } 의극한에대한 < 보기 > 의설명중옳은것을모두고르면? Ⅰ. < b n 이고 lim = 이면 lim b n =이다. Ⅱ. 두수열 { }, {b n } 이수렴할때 < b n 이면 lim < lim b n 이다. Ⅲ. lim b n =0이면 lim =0또는 lim b n =0이다. Ⅰ 2Ⅱ 3Ⅲ 4Ⅰ,Ⅱ 5Ⅰ,Ⅲ
25 강. 수열의극한참거짓 2 두수열 { }, {b n } 의극한에대한 < 보기 > 의설명중옳은것을모두고르면? Ⅰ. < b n 이고 lim = 이면 lim b n =이다. Ⅱ. 두수열 { }, {b n } 이수렴할때 < b n 이면 lim < lim b n 이다. Ⅲ. lim b n =0이면 lim =0또는 lim b n =0이다. Ⅰ 2Ⅱ 3Ⅲ 4Ⅰ,Ⅱ 5Ⅰ,Ⅲ
공개특허 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) A61K 39/395 ( ) C07K 16/18 ( ) A61P 9/10 ( ) (21) 출원번호
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) A61K 39/395 (06.01) C07K 16/18 (06.01) A61P 9/10 (06.01) (21) 출원번호 10-12-7015596( 분할 ) (22) 출원일자 ( 국제 ) 06 년 09 월 04 일 심사청구일자 12 년 07 월 13 일 (62)
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (51) 국제특허분류 (Int. Cl.) A61K 39/395 (06.01) C07K 16/18 (06.01) A61P 9/10 (06.01) (21) 출원번호 10-12-7015596( 분할 ) (22) 출원일자 ( 국제 ) 06 년 09 월 04 일 심사청구일자 12 년 07 월 13 일 (62)
공개특허 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (11) 공개번호 (43) 공개일자 2008년05월19일 (51) Int. Cl. C12N 15/81 ( ) (21) 출원번호 10
 (19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (11) 공개번호 10-2008-0043775 (43) 공개일자 2008년05월19일 (51) Int. Cl. C12N 15/81 (2006.01) (21) 출원번호 10-2008-7003088 (22) 출원일자 2008 년 02 월 05 일 심사청구일자 없음 번역문제출일자 2008 년 02 월 05
(19) 대한민국특허청 (KR) (12) 공개특허공보 (A) (11) 공개번호 10-2008-0043775 (43) 공개일자 2008년05월19일 (51) Int. Cl. C12N 15/81 (2006.01) (21) 출원번호 10-2008-7003088 (22) 출원일자 2008 년 02 월 05 일 심사청구일자 없음 번역문제출일자 2008 년 02 월 05
exp
 exp exp exp exp exp exp exp exp exp exp exp log 第 卷 第 號 39 4 2011 4 투영법을 이용한 터빈 블레이드의 크리프 특성 분석 329 성을 평가하였다 이를 위해 결정계수값인 값 을 비교하였으며 크리프 시험 결과를 곡선 접합 한 결과와 비선형 최소자승법으로 예측한 결과 사 이 결정계수간 정도의 오차가 발생하였고
exp exp exp exp exp exp exp exp exp exp exp log 第 卷 第 號 39 4 2011 4 투영법을 이용한 터빈 블레이드의 크리프 특성 분석 329 성을 평가하였다 이를 위해 결정계수값인 값 을 비교하였으며 크리프 시험 결과를 곡선 접합 한 결과와 비선형 최소자승법으로 예측한 결과 사 이 결정계수간 정도의 오차가 발생하였고
안전확인대상생활화학제품지정및안전 표시기준 제1조 ( 목적 ) 제2조 ( 정의 )
 안전확인대상생활화학제품지정및안전 표시기준 제1조 ( 목적 ) 제2조 ( 정의 ) - 1 - - 2 - 제3조 ( 안전확인대상생활화학제품지정 ) 제4조 ( 안전기준의설정 ) 제5조 ( 안전기준 ) 제6조 ( 표시기준 ) - 3 - - 4 - 제9조 ( 규제의재검토 ) 제 7 조 ( 안전기준확인제출자료 ) 제8조 ( 안전기준적용예외 ) 부칙 제1조 ( 시행일 )
안전확인대상생활화학제품지정및안전 표시기준 제1조 ( 목적 ) 제2조 ( 정의 ) - 1 - - 2 - 제3조 ( 안전확인대상생활화학제품지정 ) 제4조 ( 안전기준의설정 ) 제5조 ( 안전기준 ) 제6조 ( 표시기준 ) - 3 - - 4 - 제9조 ( 규제의재검토 ) 제 7 조 ( 안전기준확인제출자료 ) 제8조 ( 안전기준적용예외 ) 부칙 제1조 ( 시행일 )
Basic CMYK
 02 E & C MERITZ CO., LTD HISTORY of E&C MERITZ 1986.02 Established Korea Filter Corporation 1986.02 Develop and Distribute Bag Filter, Air Filter 1987.10 Contracted Alsop ENGINEERING Co / U.S.A Whole Item
02 E & C MERITZ CO., LTD HISTORY of E&C MERITZ 1986.02 Established Korea Filter Corporation 1986.02 Develop and Distribute Bag Filter, Air Filter 1987.10 Contracted Alsop ENGINEERING Co / U.S.A Whole Item
서 인코딩한 데이터를 무선으로 송신하기 위한 무선 송신 수단; 및 통화중 상기 입력 수단으로부터의 음원 데이터 전송신 호에 따라 상기 저장 수단에 저장되어 있는 해당 음원 데이터를 상기 디코딩 수단에 의해 디코딩하고, 상기 디코딩한 음원 데이터와 상기 입력 수단을 통해
 (51) Int. Cl. H04B 1/40 (2006.01) (19)대한민국특허청(KR) (12) 등록특허공보(B1) (45) 공고일자 (11) 등록번호 (24) 등록일자 2006년11월23일 10-0646983 2006년11월09일 (21) 출원번호 10-2004-0053063 (65) 공개번호 10-2006-0004082 (22) 출원일자 2004년07월08일
(51) Int. Cl. H04B 1/40 (2006.01) (19)대한민국특허청(KR) (12) 등록특허공보(B1) (45) 공고일자 (11) 등록번호 (24) 등록일자 2006년11월23일 10-0646983 2006년11월09일 (21) 출원번호 10-2004-0053063 (65) 공개번호 10-2006-0004082 (22) 출원일자 2004년07월08일
연구보고서화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인 (II) - 실험동물을이용한고감도발암성확인기법의검증 - 임경택 김수진
 연구보고서화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인 (II) - 실험동물을이용한고감도발암성확인기법의검증 - 임경택 김수진 요약문 i ii 화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인 (II) 요약문 iii iv 화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인 (II) 요약문 v vi 화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인
연구보고서화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인 (II) - 실험동물을이용한고감도발암성확인기법의검증 - 임경택 김수진 요약문 i ii 화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인 (II) 요약문 iii iv 화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인 (II) 요약문 v vi 화학물질노출에의한유전자돌연변이 ( 발암 ) 의조기확인
