휴미라 ( ).hwp
|
|
|
- 지창 남궁
- 7 years ago
- Views:
Transcription
1 효능효과 성인 1. 류마티스 관절염 메토트렉세이트를 포함한 DMARDs(disease-modifying anti-rheumatic drugs)에 대한 반응이 적절하지 않은 성인의 중등도에서 중증의 활동성 류마티스 관절염의 치료 이전에 메토트렉세이트로 치료받지 않은 성인의 중증의 활동성 및 진행성 류마티스 관 절염의 치료 이 약은 단독투여 또는 메토트렉세이트나 다른 DMARDs와 병용투여할 수 있다. 메토 트렉세이트에 내약성이 없거나 지속적인 병용투여가 부적절한 경우에는 단독투여한다. 이 약과 메토트렉세이트와의 병용투여는 관절손상 진행속도를 감소시키고(X-선측정 결 과) 신체활동기능을 향상시킨다. 2. 건선성 관절염 이전에 DMARDs(disease-modifying anti-rheumatic drugs)에 대한 반응이 적절하지 않은 성인의 활동성 및 진행성 건선성 관절염의 치료. 이 약은 다발성, 대칭성 아형을 지닌 환자의 말초 관절손상 진행속도를 감소시키고(X-선측정 결과), 신체활동기능을 향상시킨다. 3. 축성 척추관절염 (1) 강직성 척추염 기존 치료에 대한 반응이 적절하지 않은 성인의 중증의 강직성 척추염의 치료 (2) 방사선학적으로 강직성 척추염이 확인되지 않는 중증 축성 척추관절염 방사선학적 검사에서 강직성 척추염이 확인되지 않으나, 상승된 CRP 수치 및/또는 MRI상 객관적인 염증의 징후를 보이는 중증 축성 척추관절염의 치료. 이 약은 비스테 로이드성항염증제(NSAIDs) 약물에 대한 반응이 적절하지 않거나, 불내성인 환자에 사 용한다. 4. 성인 크론병(18세 이상) 코르티코스테로이드제나 면역억제제 등의 치료에 반응을 나타내지 않거나, 내약성이 없는 경우 또는 이러한 치료방법이 금기인 중등도에서 중증의 활성 크론병의 치료 유도 요법의 경우 이 약은 코르티코스테로이드제와 병용투여한다. 코르티코스테로이드 제에 내약성이 없거나, 지속적인 병용투여가 부적절한 경우 단독투여할 수 있다
2 5. 건선 싸이클로스포린, 메토트렉세이트 또는 PUVA를 포함한 전신 치료요법에 대해 반응이 없거나, 금기이거나, 내약성이 없는 성인의 중등도에서 중증의 만성 판상 건선의 치료 6. 궤양성 대장염 코르티코스테로이드 및 6-MP(6-mercaptopurine) 또는 AZA(azathioprine)를 포함한 통상적인 치료에 대해 반응이 적절하지 않거나 내약성이 없는 경우 또는 이러한 치료 방법이 금기인 성인의 중등도에서 중증의 활성 궤양성 대장염의 치료 7. 베체트 장염 스테로이드 또는 면역억제제 등의 통상적인 치료에도 적절한 반응이 나타나지 않는 베 체트 장염의 치료 8. 화농성 한선염 기존의 전신 요법에 적절한 반응을 나타내지 않는 중등도에서 중증의 활성 화농성 한 선염의 치료 소아 1. 소아 크론병(6-17세) 일차 영양요법, 코르티코스테로이드, 면역조절제 등의 치료에 적절한 반응을 나타내지 않거나, 내약성이 없는 경우 또는 이러한 치료방법이 금기인 소아 환자(6-17세)에서 중증의 활성 크론병의 치료 2. 소아 특발성 관절염 (1) 다관절형 소아 특발성 관절염 하나 이상의 DMARDs(disease-modifying anti-rheumatic drugs)에 대해 부적절한 반 응을 보인 2세 이상의 소아 및 청소년에서 활성 다관절형 소아 특발성 관절염의 치료 (2) 골부착부위염 관련 관절염 기존 치료에 적절한 반응을 나타내지 않거나 내약성이 없는 6세 이상 어린이 및 청소 년의 활성 골부착부위염 관련 관절염의 치료 3. 소아 판상 건선 국소 치료 및 광선요법에 적절한 반응을 나타내지 않거나 해당 치료가 부적절한 4세 이상의 어린이 및 청소년의 중증 만성 판상 건선의 치료 - 2 -
3 용법용량 환자가 자가 주사하는 것이 적절하며 필요시 치료 추적이 가능하다고 의사가 판단하는 경우, 환자는 주사방법에 대한 교육을 받은 후 이 약을 자가 주사할 수 있다. 성인 1. 류마티스 관절염 성인 류마티스 관절염 환자에 대한 이 약의 권장 용량은 아달리무맙 40 mg을 2주에 1회 피하 주사한다. 이 약을 투여하는 동안 메토트렉세이트의 병용투여를 유지한다. 글루코코르티코이드, 살리실산염, 비스테로이드성항염증제(NSAIDs), 진통제, 다른 DMARDs의 병용투여를 유지할 수 있다. 단독요법의 경우 이 약에 대한 반응이 감소한 환자는 40 mg 1주 1회로 증량하면 유용한 효과 를 얻을 수 있다. 2. 건선성 관절염, 강직성 척추염 및 방사선학적으로 강직성 척추염이 확인되지 않는 중증 축 성 척추관절염 건선성 관절염, 강직성 척추염 및 방사선학적으로 강직성 척추염이 확인되지 않는 중증 축성 척추관절염 환자에 대한 이 약의 권장 용량은 아달리무맙 40 mg을 2주에 1회 피하주사한다. 상기 효능 효과에 대해 임상적인 반응은 보통 치료 12주 이내에 나타나며, 이 기간 내에 반응 을 나타내지 않는 환자의 경우에는 투여 지속여부를 신중히 재고한다. 3. 성인 크론병 성인 중등도에서 중증 크론병에 대한 이 약의 권장 용량은 첫 주에 아달리무맙 80 mg을 투여 하고 첫 투여 후 2주 후에 40 mg을 투여한다. 빠른 효과를 얻어야 할 필요가 있는 경우에는, 유도 요법동안 이상 반응에 대한 위험성이 증가한다는 것을 알리고, 첫 주에 160 mg을 투여 하고(하루에 4번 주사하거나, 이틀에 걸쳐 2번씩 주사할 수 있다) 첫 투여 후 2주 후에 80 mg을 투여할 수 있다. 유도 요법의 경우 이 약은 코르티코스테로이드제와 병용투여한다. 코르 티코스테로이드제에 내약성이 없거나, 지속적인 병용투여가 부적절한 경우 단독투여할 수 있 다. 유도 요법 후, 아달리무맙 40 mg을 2주에 1회 피하주사한다. 만약 투여를 중지하고 재발의 증상과 징후가 나타나면 이 약을 재투여 할 수 있다. 8주 이상의 투여 중지 후 재투여에 대한 경험은 거의 없다. 유지 요법 동안 임상 지침에 따라 코르티코스테로이드제의 투여를 서서히 줄일 수 있다. 이 약에 대한 반응이 감소한 환자는 40 mg 1주 1회로 증량하면 유용한 효과를 얻을 수 있다. 4주까지 반응을 보이지 않는 환자의 경우 12주까지 투여하여 반응을 나타낼 수 있다. 이 기간 내에 반응을 나타내지 않는 환자의 경우에는 투여 지속여부를 신중히 재고한다. 4. 건선 성인에 대한 이 약의 권장 용량은 첫 회에 아달리무맙 80 mg을 피하로 투여하고, 이어서 첫 - 3 -
4 투여 후 1주일 후에 40 mg을 격주로 투여한다. 16주 이내에 반응을 나타내지 않는 환자의 경우에는 투여 지속여부를 신중히 재고한다. 5. 궤양성 대장염 성인 중등도에서 중증의 궤양성 대장염에 대한 이 약의 권장 용량은 아달리무맙 160 mg을 투 여하고(하루에 4번 주사하거나 이틀에 걸쳐서 2번씩 주사할 수 있다) 첫 투여 2주 후에 80 mg을 투여하는 것이다. 유도 요법 후 40 mg을 격주로 피하주사한다. 유지 요법 동안 임상 지침에 따라 코르티코스테로이드제의 투여를 서서히 줄일 수 있다. 이 약에 대한 반응이 감소한 환자 중 일부는 40 mg 1주 1회로 증량하여 유용한 효과를 얻을 수 있다. 지금까지 나온 데이터에 따르면 임상 반응은 대체로 투여 2-8주 이내에 도달한다. 이 기간 내 에 반응을 보이지 않은 환자의 경우 투여 지속여부를 신중히 재고한다. 6. 베체트 장염 성인에 대한 이 약의 권장 용량은 첫 회에 160 mg을 피하로 투여하고 이어서 첫 투여 2주 후 에 80 mg을 투여한다. 첫 투여 4주 후부터는 40 mg을 격주로 투여한다. 12주 이내에 반응을 나타내지 않는 환자의 경우에는 투여 지속 여부를 신중히 재고한다. 7. 화농성 한선염 이 약의 권장용량은 첫 회에 160 mg을 피하로 투여하고 (하루에 4번 주사하거나, 이틀에 걸 쳐 2번씩 주사할 수 있다), 이어서 첫 투여 2주 후에 80 mg을 투여한다(하루에 2번 주사한 다). 첫 투여 4 주 후 부터는 40 mg을 매 주 투여한다. 필요 시, 이 약의 치료 기간 동안 항 생제를 계속 투여할 수 있다. 12주 이내에 반응을 나타내지 않는 환자의 경우에는 투여 지속 여부를 신중히 재고한다. 치료를 중단해야 하는 경우, 40mg 매주 투여로 재투여할 수 있다. 소아 1. 소아 크론병 체중이 < 40 kg인 소아 크론병 환자 소아 중증 크론병에 대한 이 약의 권장 용량은 첫 주에 아달리무맙 40 mg을 투여하고 첫 투 여 후 2주 후에 20 mg을 투여한다. 빠른 효과를 얻어야 할 필요가 있는 경우에는, 유도 요법 동안 이상반응에 대한 위험성이 증가한다는 것을 알리고, 첫 주에 80 mg을 투여하고(하루에 2번 주사할 수 있다) 첫 투여 후 2주 후에 40 mg을 투여할 수 있다. 유도 요법 후, 이 약 20 mg을 2주에 1회 피하 주사한다. 충분한 반응이 나타나지 않는 일부 환자의 경우 매주 이 약 20 mg 투여로 빈도를 높이는 것이 유익할 수 있다. 체중이 40 kg인 소아 크론병 환자 소아 중증 크론병에 대한 이 약의 권장 용량은 첫 주에 80 mg을 투여하고 첫 투여 후 2주 후 에 40 mg을 투여한다. 빠른 효과를 얻어야 할 필요가 있는 경우에는, 유도 요법동안 이상반응 - 4 -
5 에 대한 위험성이 증가한다는 것을 알리고, 첫 주에 160 mg을 투여하고(하루에 2번 주사할 수 있다) 첫 투여 후 2주 후에 80 mg을 투여할 수 있다. 유도 요법 후, 이 약 40 mg을 2주에 1회 피하주사한다. 충분한 반응이 나타나지 않는 일부 환자의 경우 매주 이 약 40 mg 투여로 빈도를 높이는 것이 유익할 수도 있다. 12주까지 반응을 나타내지 않는 환자의 경우에는 투여 지속 여부를 신중히 재고한다. 2. 소아 특발성 관절염 (1) 다관절형 소아 특발성 관절염 이 약은 2세 미만 소아를 대상으로 연구된 바 없다. 체중 15 kg 미만 소아 환자 대상 치료에 대한 가능한 데이터는 제한적이다. 이 약은 메토트렉세이트와 병용하여 투여한다. 메토트렉세이트에 내약성이 없거나 메토트렉세 이트와 함께 지속적으로 투여하는 것이 부적절할 경우에는 이 약을 단독요법으로 투여할 수 있다. 2~12세 이상의 다관절형 소아 특발성 관절염 2 12세 다관절형 소아 특발성 관절염 환자에 대한 이 약의 권장 용량은, 24 mg/m2 BSA(body surface area)에서 최대 아달리무맙 40 mg(4-12세) 또는 20 mg(2-4세 미만)을 단회 피 하주사를 통해 격주 투여한다. 주사 용량은 환자의 신장 및 체중에 따라 선택한다(표 1). 표 1. 다관절형 소아 특발성 관절염 소아의 신장 및 체중에 따른 용량(ml) 신장 (cm) 체중(kg) * * 0.8* * 0.8* 0.8* 0.8* * 0.8* 0.8* 0.8* 0.8* * 0.8* 0.8* 0.8* 0.8* 0.8* * 최대 단회 투여량 : 2-4세 미만 20 mg(0.4 ml), 4-12세 40 mg(0.8 ml) 13세 이상의 다관절형 소아 특발성 관절염 13세 이상의 청소년의 경우 체표면적과 상관없이 40 mg을 격주로 투여한다. 40 mg 용량을 모두 투여하는 환자의 경우 40 mg 펜과 40 mg 프리필드시린지도 가능하다. 지금까지 나온 데이터에 따르면 임상 반응은 대체로 투여 12주 이내에 도달한다. 이 기간 내 - 5 -
6 에 반응을 보이지 않은 환자의 경우 투여 지속여부를 신중히 재고한다. (2) 골부착부위염 관련 관절염 6세 이상의 골부착부위염 관련 관절염 환자에 대한 이 약의 권장용량은 24 mg/m2 body surface area에서 최대 아달리무맙 40 mg을 단회 피하주사를 통해 격주 투여한다. 주사 용량 은 환자의 신장 및 체중에 따라 선택한다(표 2). 표 2. 골부착부위염 관련 관절염 환자의 신장 및 체중에 따른 용량 (ml) 신장 (cm) 체중(kg) * * 0.8* * 0.8* 0.8* 0.8* * 0.8* 0.8* 0.8* 0.8* * 0.8* 0.8* 0.8* 0.8* 0.8* * 최대 단회 투여량 : 40 mg(0.8 ml) 이 약은 6세 미만의 골부착부위염 관련 관절염 환자를 대상으로 연구된 바 없다. 3. 소아 판상 건선 소아 판상 건선에 대한 이 약의 권장용량은, 0.8mg/kg (1회 최대 용량 40 mg)을 처음 2회는 매주 피하주사하고, 이후에는 격주로 투여한다. 16주 이후에도 반응을 나타내지 않는 환자의 경우에는 투여 지속여부를 신중히 재고한다. 만약 이 약으로 다시 치료할 경우, 위에서 제시한 용량과 치료기간을 따라야 한다. 소아 판상 건선으로 4세 미만의 어린이에게 이 약을 사용한 적은 없다. 주사 용량은 환자의 체중에 따라 선택한다 (표 3). 표 3. 소아 판상 건선 환자의 체중에 따른 용량(mL) 체중 (kg) 소아 판상 건선 용량 ml (10 mg) ml (15 mg) ml (20 mg) ml (25 mg) ml (30 mg) ml (35 mg) ml (40 mg) - 6 -
7 사용상 주의사항 1. 경고 1) 감염 : 이 약의 투여 전, 투여 동안 및 투여 후 결핵을 포함한 감염에 대해 면밀히 모니터 링해야 한다. 이 약의 배설에 5개월까지 소요될 수 있으므로 이 기간 동안 모니터링을 지속 해야 한다. 만성 또는 국소화된 감염 등 활동성 감염 환자의 경우 감염이 조절될 때까지 이 약의 투여를 시작해서는 안 된다. 결핵에 노출된 환자 및 결핵의 위험이 높은 지역 또는 히 스토플라스마증, 콕시디오이데스진균증, 또는 분아균증(blastomycosis) 같은 풍토병성 진균 증의 위험이 높은 지역을 여행한 환자들은, 치료를 시작하기 전 이 약의 치료로 인한 위험 및 이익에 대하여 고려하여야 한다. 이 약의 투여 동안 새로운 감염이 발생한 환자는 면밀 히 모니터링해야 하며, 완벽한 진단 평가를 거쳐야 한다. 만약 새로운 심각한 감염 또는 패 혈증이 발생한 환자의 경우 감염이 조절될 때 까지 이 약의 투여를 중단해야 하며, 적절한 항균 또는 항진균 치료를 시작해야 한다. 재발성 감염 병력 또는 감염되기 쉬운 기저상태 (면역억제제를 병용 투여 하는 경우 포함)에 있는 환자에게 이 약의 투여를 고려하는 의사 는 주의를 기울여야 한다. 세균성, 진균성, 침습적 진균(파종성 또는 폐외 히스토플라스마증, 아스페르길루스증, 콕시 디오이데스진균증), 바이러스성으로 인한 중대한 감염, 기생충에 의한 감염 또는 기타 기회 감염이 TNF 저해제를 투여 받고 있는 환자들에게서 보고되었다. 또한 패혈증, 드물게 결핵, 칸디다증, 리스테리아증, 레지오넬라증 및 뉴모시스티스(pneumocystis)가 이 약을 포함한 TNF 저해제의 사용에서 보고되었다. 감염과 관련된 입원 또는 치명적인 결과가 보고되었으 며, 심각한 감염은 대부분 선행 질환과 함께 감염을 일으키기 쉬운 면역억제제를 병용 투여 한 환자에서 발생했다. 1 심각한 감염 이 약을 투여받고 있는 환자에게 심각한 감염의 위험이 증가되는 경우가 임상시험에서 나타 났으며, 시판 후 조사에서 이러한 사실을 뒷받침하는 보고가 있었다. 특히 폐렴, 신우신염, 패혈성 관절염, 패혈증과 같은 심각한 감염이 보고되었다. 2 결핵 이 약을 투여받고 있는 환자에게서 결핵(재활성화 및 발병 포함)이 보고되었으며, 폐결핵 및 폐외결핵(예, 파종성)이 포함되었다. 이 약으로 치료를 시작하기 전 모든 환자의 활동성 또는 비활동성(잠복성) 결핵 감염에 대 해 평가해야 한다. 이 평가에는 개인의 결핵 병력 또는 과거에 활동성 결핵 환자에 노출되 었을 가능성과 과거 및 현재 면역억제요법에 대한 자세한 의학적 평가가 포함되어야 한다. 모든 환자에서 투베르쿨린 피부 검사와 흉부 X-선과 같은 적절한 스크리닝 시험을 실시해 야 한다(국가별 권장사항을 적용할 수 있음). 특히 결핵이 널리 유행되는 지역에서 이민오거나 혹은 그곳을 여행한 환자들 또는 활동성 결핵 환자와 긴밀한 접촉이 있었던 환자들에서 진단되지 않은 잠복성 결핵이 가능하다는 것 을 고려해야만 한다. 활동성 결핵으로 진단된 경우에는 이 약의 투여를 시작해서는 안 된다. 잠복성 결핵으로 진단된 경우에는, 이 약의 투여 시작 전 항결핵 예방요법과 함께 적절한 - 7 -
8 치료를 시작해야 하며, 국가별 권장사항에 따라야 한다. 결핵 테스트 결과가 음성일지라도 결핵의 중대한 위험인자를 갖고 있거나 여러 위험인자가 있는 환자 및 과거 활성 또는 잠복 성 결핵의 병력이 있으나 적절한 치료가 확인되지 않은 환자 또한 이 약의 투여 시작 전에 항결핵 예방요법을 고려해야한다. 이 환자에 대한 항결핵 치료 시작은 잠복성 결핵 감염에 대한 위험과 항결핵 치료의 위험 두 가지를 모두 고려한 후에 결정되어야만 한다. 만약 필 요하다면, 결핵치료의 경험이 있는 의사와 상담하여야만 한다. 잠복성 결핵 감염 환자의 항결핵 치료는 이 약을 투여받는 환자들의 결핵 재활성화 위험을 감소시킨다. 항결핵 예방요법에도 불구하고, 이 약을 투여 받는 동안 활동성 결핵이 발생한 경우가 있었다. 또한 잠복성 결핵 결과가 음성이었던 환자에서 이 약을 투여받고 활성 결핵 이 발생하고, 활성 결핵 치료가 성공적으로 실시된 몇몇 환자에서도 TNF 저해제로 투여받 는 동안 활성 결핵이 다시 나타난 바가 있다. 이 약으로 치료받는 환자는 잠복성 결핵이 위음성일 수 있으므로, 활성 결핵의 증상 및 징 후가 모니터링되어야 한다. 투베르쿨린 위음성(false negative) 결과의 위험은 중증 질환자 나 면역기능저하환자에서 특히 고려해야한다. 만약 이 약으로 치료하는 동안이나 치료 후 결핵을 암시하는 증상/징후(예. 지속성 기침, 쇠 약/체중감소, 미열, 무기력)가 나타나는 경우 의사에게 즉시 알리도록 환자를 교육해야 한 다. 3 기타 기회감염 침습적 진균 감염을 포함한 기회감염이 이 약을 투여 받고 있는 환자들에서 관찰되었다. 이 감염들은 TNF 저해제를 투여 받고 있는 환자들에게서 일관되게 나타나지는 않았으며, 이는 적절한 치료의 지연을 야기하였고, 때로는 치명적인 결과를 초래하였다. TNF 저해제를 투여받고 있는 환자들은 히스토플라스마증, 콕시디오이데스진균증, 또는 분아 균증(blastomycosis), 아스페르길루스증, 칸디다증 및 기타 기회감염들에 좀 더 감수성이 높 다. 발열, 권태감, 체중 감소, 발한, 기침, 호흡곤란 및/또는 폐 침윤, 또는 기타 심각한 (쇼 크를 동반하거나 동반하지 않은) 전신질환이 나타난 환자는 즉시 진단 평가를 위한 의학적 조치를 취해야 한다. 진균증이 풍토병인 지역에 머물거나 여행한 환자의 경우, 전신적인 진균 감염의 징후가 나 타나면, 침습적인 진균 감염을 의심해야 한다. 환자들은 히스토플라스마증 및 기타 침습적 진균 감염의 위험이 있으므로, 임상 의사들은 병원균이 확인되기 전까지 실험적 항진균 치 료를 고려해야 한다. 활성 감염 상태인 몇몇의 환자들은 히스토플라스마증의 항원 및 항체 검사에서 음성을 나타낼 수 있다. 이러한 환자들에게 실험적 항진균 치료제의 투여는, 침습 적 진균 감염의 치료 및 진단에 전문가인 의사와 상담하여 결정되어야 하며, 심각한 진균 감염의 위험 및 항진균 치료의 위험을 모두 고려하여야 한다. 심각한 진균 감염이 발생한 환자 또한 감염이 조절되기 전까지 TNF 저해제의 사용 중단이 고려되어야 한다. 2) 악성종양과 림프증식성 질환 TNF 저해제에 대한 임상시험의 대조 시험동안 TNF 저해제를 투여받은 환자에서 대조군 환 자에 비해 더 많은 림프종 사례가 관찰되었다. 그러나 발생이 드물었고 위약군 환자의 추적 조사기간이 TNF 저해제를 투여받은 환자에 비해 더 짧았다. 더욱이 오래 지속된, 매우 활 동성인, 염증성 질환을 가진 류마티스 관절염 환자는 림프종의 기저 위험(background risk) 이 증가되어 있고 이는 위험 추정을 어렵게 한다. 이 약을 이용한 장기간 공개 임상시험에 - 8 -
9 서 악성종양의 전체 발현율은 나이, 성별, 인종이 맞춰진 전체 인구에서 예상되는 발현율과 유사했다. 현재의 지식으로 TNF 저해제를 투여받는 환자에서 림프종 또는 다른 악성종양의 발생 위험 가능성을 배제할 수 없다. TNF 저해제를 투여받는 어린이와 청소년들에서 악성종양이 보고되었고, 일부는 치명적이었 다. 이 보고된 경우 중 대략 절반의 경우는 호지킨 및 비호지킨 림프종을 포함한 림프종이 었다. 나머지 다른 경우들에서는 여러 다양한 악성 종양들이 나타났으며, 일반적으로 면역 억제와 연관되어 드물게 나타나는 악성종양도 포함되었다. 악성종양은 중간값으로 치료 30 개월 후에 나타났으며, 대부분의 환자가 면역억제제를 병용 투여하고 있었다. 이는 시판 후 조사에서 보고되었으며, 등록과 자발적인 시판 후 보고서를 포함한 여러 경로에서 나타났 다. 이 약을 투여받은 환자에서, Hepatosplenic T-cell lymphoma(hstcl)가 시판후 조사에서 매우 드물게 보고되었고, 공격적 림프종(종종 치명적임)이 드물게 확인되었다. 대부분의 환 자들은 염증성대장질환의 치료를 위하여 아자티오프린 또는 6-메르캅토푸린의 병용 투여는 물론이고 이전에 인플리시맵으로 치료를 받았었다. 이 약과 아자티오프린 또는 6-메르캅토 푸린의 병용 투여 시의 잠재적인 위험성을 주의깊게 고려해야 한다. 이 약 복용환자에서 HSTCL의 발생 위험 가능성은 배제할 수 없다 악성종양의 병력이 있는 환자를 포함하거나 이 약 투여 중 악성종양이 발생한 환자에게 투 여를 지속한 시험은 실시되지 않았다. 따라서 이러한 환자군에 투여를 고려시 추가적인 주 의를 기울여야 한다. 모든 환자, 특히 과다한 면역억제제 치료의 병력이 있는 환자나, PUVA 치료의 병력이 있는 건선 환자들은 이 약의 투여 시작 전 및 투여 기간 동안 비흑색 종 피부암 존재 여부에 대한 검사를 받아야 한다. TNF 저해제를 류마티스 관절염과 다른 적응증에서 사용하여 급성 및 만성 백혈병이 나타 난 경우가 보고되었다. 류마티스 관절염이 있는 환자들은 TNF 저해제를 투여받지 않더라도 다른 사람들에 비해 백혈병이 발병될 확률이 (2배까지) 높을 수 있다. 중등증에서 중증의 만성 폐쇄성 폐질환(COPD) 환자들을 대상으로 다른 TNF 저해제인 인플릭 시맵을 사용하여 실시한 탐색적 임상시험에서, 현재 흡연중이거나 기존에 흡연하였던 사람의 경우 비교군의 환자보다 인플릭시맵 치료를 받은 환자군에서 악성 종양이 많이 보고되었다. 과 도한 흡연으로 인해 악성종양의 위험성이 증가한 환자는 물론 만성 폐쇄성 폐질환(COPD) 환자에 대한 TNF-α 저해제 치료 고려 시 주의가 필요하다. 이 약이 형성이상증이나 대장암의 발생 위험에 영향을 미치는지 여부는 현재 알려지지 않 았다. 형성이상증 또는 대장암종의 위험이 증가되었거나(예, 오래 지속되는 궤양성 대장염 또는 원발성 경화성 담관염), 형성이상증 또는 대장암종의 병력이 있는 모든 궤양성 대장염 환자들은 치료 시작 전 및 치료 중에 주기적으로 형성이상증에 대해 확인해야한다. 대장 내 시경검사 및 생검 등 국가별 권장사항에 따라 평가한다. 3) B형 간염 재활성화 이 약을 포함한 TNF 저해제의 사용으로 B형 간염 만성 보균자에서 병증이 재활성화 될 수 있으며, 일부는 치명적이었다. 이 보고내용의 대부분은 다른 면역억제제를 함께 투여받는 환자에게서 나타났으며, 이는 또한 B형 간염 재활성화를 일으킬 수 있다. B형 간염의 감염 위험이 있는 환자는 이 약을 투여 받기 전 감염 여부에 대한 검사를 하여야 한다. B형 간 염 보균자로 확인된 환자에게 TNF 저해제를 처방하는 경우, 의사는 주의를 기울여야 한다
10 B형 간염 보균자이고, TNF 저해제의 치료를 요하는 환자는 이 약을 투여 받는 동안과 투여 가 끝난 후 수 개월 동안 감염의 증상/징후를 철저히 관찰해야 한다. B형 간염 보균자의 재 활성화를 방지하기 위해 항바이러스제와 TNF 저해제를 함께 사용하는 것에 대한 적절한 치 료법은 알려진 바 없다. B형 간염이 재활성화 된 경우 이 약의 투여를 중지하고 적절한 치 료와 함께 항바이러스제 치료를 시작해야 한다. 4) 신경학적 반응 이 약을 포함한 다른 TNF 저해제는 드물게, 다발성 경화증 및 시신경염을 포함한 중추신경 계 탈수초성질환(demyelinating disease)과 길랑 바레 증후군(Guillian Barre syndrome)을 포함한 말초 탈수초성질환의 임상 증상 및/또는 방사선 증거의 새로운 발현 혹은 악화와 관 련이 있다. 중추신경계 및 말초신경계 탈수초성질환의 기왕력이 있거나 최근에 발현된 환자 에게 이 약의 투여를 고려하는 경우 주의를 기울여야 한다. 2. 다음 환자에는 투여하지 말 것 1) 이 약 또는 이 약의 성분에 과민증인 환자 2) 활동성 결핵 또는 패혈증, 기회감염과 같은 다른 중증 감염이 있는 환자(경고항 참조) 3) 중등도 내지 중증의 심부전(NYHA class III/IV) 환자 3. 유해사례 1) 이 약은 치료적 확증 대조 및 공개 임상시험을 통해 60개월 이상에 걸쳐 9,035명의 환자에 대하여 연구되었다. 이 임상시험들에는 단기 및 장기 질병상태를 보이는 류마티스 관절염 환자뿐만 아니라 건선성 관절염 및 축성 척추관절염(강직성 척추염 및 방사선학적으로 강직 성 척추염이 확인되지 않는 중증 축성 척추관절염) 환자 및 크론병 환자, 궤양성 대장염 환 자 및 건선 환자, 화농성 한선염 환자와 소아 특발성 관절염 (다관절 소아 특발성 관절염 및 골부착부위염 관련 관절염) 환자가 포함되었다. 표 1의 자료는 대조 임상시험 기간 동안 이 약을 투여받은 5,839명의 환자와 위약 또는 활성 대조약을 투여받은 3,551명의 환자를 포함한 주요 대조 임상시험 결과를 근거로 한 것이다. 주요 임상시험 중 이중 눈가림, 대조 임상시험 기간 동안 유해사례로 인해 투여를 중단한 환자의 비율은 이 약 투여군이 5.7%이 고 대조군이 5.4%였다. 일반적으로 소아환자에서의 유해사례는 성인 환자에서 나타난 유해사례의 빈도 및 타입과 유사하였다. 이 약을 이용한 대조 임상시험에서 가장 빈번히 나타났던 유해사례들 중 하나를 근거로 약 13%의 환자들이 주사부위반응을 경험할 것으로 예상할 수 있다. 아래 표 1은 주요 임상시험에서 임상적 및 실험실 검사 모두 적어도 이 약과 인과관계의 가능성이 있는 약물유해반응을 발현부위와 빈도별(매우 -1/10 이상 ; -1/100 이상 및 1/10 미만 ; -1/1,000 이상 및 1/100 미만 ; 드물게-1/1,000 미만)로 요약하였 다. 각각의 발현빈도 그룹 안에, 약물유해반응은 심각성이 감소하는 순서로 배열되었다. 이 약의 여러 적응증에서 가장 나타난 약물유해반응들이 포함되었다. 신체기관 열에서 (*)로 표시된 부분은 1. 경고, 4. 일반적 주의 항에서 자세한 내용을 확인할 수 있다
11 2) 베체트 장염 : 일본의 베체트 장염 연구에서의 안전성 프로파일은 이미 연구된 이 약의 안 전성 프로파일과 유사하였다. 3) 화농성 한선염: 이 약으로 매주 치료받은 화농성 한선염 환자의 안전성 프로파일은 이미 알 려진 이 약의 안전성 프로파일과 유사하였다. <표 1. 임상시험 중 약물유해반응> 신체기관 빈도 약물유해반응 감염 매우 기도 감염(상기도 및 하기도 감염, 폐렴, 부비동염, 인두염, 비인두염, 폐렴 헤르페스 바이러스 포함) 전신 감염(패혈증, 칸디다증, 인플루엔자 포함), 장내 감염 (위장염바이러스 포함), 피부 및 연조직 감염(손발톱주위염, 연조직염, 괴사성 근막염, 바이러스성 수막염, 게실염, 상처 감염, 농가진, 괴사근막염, 대상포진), 귀 감염, 구내감염(단 순포진, 구강 헤르페스, 치아 감염 포함), 생식기 감염(진균 성 외음부 및 질 감염 포함), 비뇨기계 감염(신우신염 포함), 진균 감염, 관절 감염 양성, 악성 및 미확인 신생물(낭종 및 폴립 포 함)(*) 혈액계 및 림프계 이상 (*) 매우 드물게 기회감염과 결핵(콕시디오이데스진균증, 히스토플라스마증, 계형결핵균 복합체 감염), 신경 감염(바이러스성 수막염 포 함), 눈 감염, 박테리아 감염 양성종양, 악성흑색종을 제외한 피부암(기저세포암, 편평세 포암을 포함) 림프종, 실질기관종양(유방암, 폐종양, 갑상선 종양 포함), 악성흑색종 백혈구감소증(호중구감소증, 무과립구증 포함), 빈혈 저혈소판증, 백혈구증가증 특발성 혈소판감소성 자반증 범혈구감소증 면역계 이상 과민반응, 알레르기(계절성 알레르기 포함) 대사 및 영양계 이상 매우 지질증가 저칼륨혈증, 고뇨산혈증, 혈중나트륨농도이상, 저칼슘혈증, 고혈당증, 저인산혈증, 탈수증 정신계 이상 감정이상(우울증 포함), 불안, 불면증 신경계 이상 매우 두통 피부지각이상(감각저하증 포함), 편두통, 신경뿌리압박 떨림, 신경병증
12 드물게 다발성경화증 눈의 이상 시각장애, 결막염, 눈꺼풀염, 눈부종 귀 및 미로 이상 복시 심장 이상 빈맥 드물게 어지럼증 난청, 이명 부정맥, 울혈성 심부전 심정지 혈관 이상 고혈압, 홍조, 혈종 호흡, 흉부 및 종격 이상 위장관계 이상 매우 혈관동맥 폐색증, 혈전정맥염, 대동맥류 기침, 천식, 호흡곤란 만성 폐쇄성 폐질환, 간질성 폐질환, 폐렴 복통, 구역 및 구토 위장관출혈, 소화불량, 위식도역류 질환, 건조증후군 간 및 담즙계 매우 췌장염, 연하곤란, 얼굴부종 간 효소 상승 피부 및 피하 조직 이상 근 골 격 계 및 결 합 조 직 이 상 신장 및 비뇨 이상 생식기계 및 유방 이상 전신이상 및 투여 부위 이상 임상 실험실 검사 매우 매우 매우 담낭염, 담석증, 빌리루빈 상승, 지방간 발진(박리성 발진 포함) 가려움증, 두드러기, 타박상(자색반증 포함), 피부염(습진 포 함), 조갑박리증, 다한증 야간발한, 흉터 근골격통 근경련(혈중크레아틴인산활성효소 증가 포함) 횡문근융해, 전신홍반루프스 혈뇨, 신기능 손상 야뇨증 발기부전 주사부위반응(주사부위 홍반 포함) 흉통, 부종 염증 응고 및 출혈이상(활성화부분트롬보플라스틴시간 지연 포 함), 자가항체시험 양성(이중나선DNA항체 포함), 혈중 락트
13 상해 및 중독 산탈수효소 증가 치유 부전 기타 유해사례 이 약으로 치료를 받은 류마티스 관절염 환자에게 5% 미만의 드문 발생률로 나타난 기타 중 대한 유해사례는 다음과 같다. 전신 : 발열, 감염, 극심한 통증, 골반 통증, 패혈증, 수술, 가슴통증, 결핵의 재발 심혈관계 : 부정맥, 심방 세동, 심혈관 장애, 흉통, 울혈성 심부전, 관상동맥 이상, 심정지, 고혈압성 뇌병증, 심근경색증, 심계항진, 심낭삼출, 심낭염, 실신, 빈맥, 혈관 장애 콜라겐 질환 : 홍반성 루푸스 증후군 소화기계 : 담낭염, 담석증, 식도염, 위염, 위장장애, 위장출혈, 간 괴사, 구토 내분비계 : 부갑상선 장애 혈액계 : 무과립구증, 과립구감소증, 백혈구감소증, 림프종 유사반응, 범혈구감소증, 적혈 구증가증 대사 및 영양장애 : 탈수증, 치유 이상, 케톤증, 파라프로테인혈증, 말초부종 근골격계 : 관절염, 뼈장애, 뼈골절(자연적인 경우가 아닌), 골괴사, 관절장애, 근육경련, 중증근무력증, 화농성 관절염, 윤활막염, 힘줄 장애 종양 : 샘종, 유방 위장관 피부 비뇨생식과 같은 암종 및 기타(림프종, 흑색종) 신경계 : 착란, 다발성 경화증, 감각이상, 경막하혈종, 떨림 호흡기계 : 천식, 기관지연축, 호흡곤란, 폐 장애, 폐기능 감소, 흉막 삼출, 폐렴 피부 및 부속물 : 연조직염, 얕은 연조직염, 대상포진 특수감각 : 백내장 혈전증 : 다리혈전 비뇨생식기계 : 방광염, 신장 결석, 월경 장애, 신우신염 4) 주사부위반응 : 성인 및 소아에 대한 주요 대조 임상시험에서 이 약을 투여한 환자의 12.9%가 이 약을 투여했을 때 가장 흔히 나타난 유해사례인 주사부위반응(홍반 및/또는 가 려움증, 출혈, 통증 또는 부종)을 나타낸 반면, 위약 또는 활성 대조군을 투여한 환자에서는 7.1%에서 이러한 반응이 나타났다. 주사부위반응은 일반적으로 투여 중단이 필요하지는 않 았다. 5) 감염 : 성인 및 소아에 대한 주요 대조 임상시험에서, 감염률은 이 약 투여군이 1.51/환자- 년(patient year)이고 위약 및 활성 대조약 투여군은 1.46/환자-년이었다. 감염은 주로 비인 두염, 상기도 감염 및 부비동염으로 구성되었다. 대부분의 환자들은 감염이 소실된 후 이 약을 계속 투여하였다. 심각한 감염 발생률은 이 약 투여군이 0.04/환자-년이고 위약 및 활 성 대조약 투여군은 0.03/환자-년이었다. 이 약을 이용한 성인 및 소아에 대한 대조 및 공 개 임상시험에서 심각한 감염(드물게 발생한 치명적 감염을 포함)이 보고되었으며, 이는 결 핵(속립성 및 폐 이외 부위 포함) 및 침습적 기회 감염(예. 파종성 히스토플라스마증, 폐포 자충 폐렴, 아스페르길루스증 및 리스테리아증)을 포함한다. 결핵 사례의 대부분은 치료 시
14 작 후 최초 8개월 이내에 발생하였으며, 이는 잠복 질환의 재발을 반영하는 듯하다. 6) 악성종양과 림프증식성 질환 : 소아 특발성 관절염(다관절형 소아 특발성 관절염 및 골부착부위 염 관련 관절염) 환자를 대상으로 환자-년 노출된 249명에서의 임상시험 동안 악성종 양이 관찰되지 않았다. 또한, 소아 크론병 환자를 대상으로 환자-년 노출된 192명에 서의 임상시험 동안 악성종양이 관찰되지 않았다. 판상 건선 소아 환자를 대상으로 80.0 환 자-년 노출된 77명의 소아 환자에서의 임상시험 동안 악성 종양이 관찰되지 않았다. 중등 도에서 중증의 류마티스 관절염, 건선성 관절염, 축성 척추관절염(강직성 척추염 및 방사선 학적으로 강직성 척추염이 확인되지 않는 중증 축성 척추관절염), 크론병, 궤양성대장염, 화 농성 한선염 및 건선 환자를 대상으로 12주 이상 실시한 성인에 대한 주요 대조 임상시험 에서 림프종, 비흑색종 피부암 이외에도 악성종양이 투여군 5,041명 중에서 6.1/1,000 환 자-년, 대조군 3,194명 중에서 6.9/1,000 환자-년의 비율로 생성되었다(치료기간의 중간값 은 이 약의 투여군에서는 4.0개월, 대조군에서는 3.9개월이었다). 비흑색종 피부암은 투여 군에서 9.0/1,000 환자-년 및 대조군에서 3.4/1,000 환자-년의 비율로 생성되었다. 피부암 중에서 편평세포암종은 투여군에서 2.5/1,000 환자-년, 대조군에서 0.7/1,000 환자-년의 비율로 생성되었다. 림프종의 비율은 투여군에서 0.7/1,000 환자-년, 대조군에서 0.7/1,000 환자-년이었다. 대조 임상시험과 진행 중 또는 완료된 공개 연장 시험에서, 림프종 및 비흑색종 피부암 이 외에 관찰된 악성종양의 발생률은 약 8.5/1,000 환자-년이다. 비흑색종 피부암의 관찰된 비율은 약 9.7/1,000 환자-년이며, 림프종이 관찰된 비율은 약 1.3/1,000 환자-년이다. 이 임상시험기간의 중앙값은 약 3.4년이며, 최소 1년 동안 이 약을 투여받은 6,008명의 환자 들 또는 25,446 환자-년 투여를 초과하는 치료 시작 1년 이내에 악성종양으로 발전한 환자 들을 포함했다. 2003년 1월부터 2010년 12월까지의 시판 후 경험 중 주로 류마티스 관절염 환자에서 보고 된 악성종양의 발생 비율은 약 2.7/1,000 환자-년 이었다. 비흑색종 피부암과 림프종의 발 생 비율은 각각 약 0.2 및 0.3/1,000 환자-년이었다. 7) 자가항체 : 류마티스 관절염에 대한 5건의 임상시험 중 여러 시점에서 혈청 내 자가항체에 대 한 검사를 실시했다. 이러한 적절히 디자인된 대조 임상시험에서 기저 항 핵항체(ANA, anti-nuclear antibody)가 음성이었던 환자 중 이 약 투여군의 11.9%와 위약 및 활성 대조 군의 8.1%에서 24주째 양성을 나타냈다. 모든 류마티스 관절염과 건선성 관절염에 대해 이 약을 투여받은 3,441명 중 2명에서 새롭게 발생된 루프스양 증후군임을 시사하는 임상 증 상이 나타났으며 이 환자는 투여 중단 후 개선되었다. 루프스성 신장염이나 중추신경계 증 상이 나타난 환자는 없었다. 8) 건선 : 발현 및 악화 이 약을 포함하여 TNF 저해제를 사용 시, 농포성 건선 및 손발바닥 건선을 포함하여 건선 이 첫 발현되는 경우와 이미 존재하던 건선이 악화되는 경우들이 보고되었다. 이 환자들의 대다수는 면역억제제(예. MTX, 코르티코스테로이드)를 병용하고 있었으며, 일부는 입원치료 가 필요했다. 대부분의 환자는 TNF 저해제의 복용을 중단함으로써 건선이 호전되었다. 일부 환자들은 이후, 다른 TNF 저해제를 재 투여했을 때 건선이 재발하였다. 국소 치료에도 불구 하고 증상이 호전되지 않거나, 악화되는 심각한 경우에는 이 약의 투여 중지를 고려해야만
15 한다. 9) 간 효소 상승 류마티스 관절염 임상시험 : 류마티스 관절염에 대한 대조 임상시험에서(4건의 임상시험), ALT의 상승은 이 약 또는 위약을 투여한 환자에서 유사했다. 초기 류마티스 관절염 환자에 서(3년 미만의 유병기간)(1건의 임상시험), ALT의 상승은 병용 투여군(이 약/메토트렉세이 트)에서 메토트렉세이트 단독군 또는 이 약 단독군에 비해 더 발생했다. 다관절형 소 아 특발성 관절염 환자를 대상으로 한 임상시험에서 일부 트랜스아미나제의 상승이 나타났 으나 위약과 이 약 투여군에서 같거나 유사했으며, 대부분은 메토트렉세이트와 병용 투여 시 나타났다. 건선성 관절염 임상시험 : ALT의 상승은 류마티스 관절염 임상시험의 환자에 비해 건선성 관절염 환자에 대한 임상시험(2건의 임상시험)에서 더 발생하였다. 모든 류마티스 관절염, 다관절형 소아 특발성 관절염 및 건선성 관절염 임상시험에서, 상승 된 ALT를 나타내는 환자들은 증상이 없었고, 대부분 상승이 일시적이며 투여 지속시 소실 되었다. 크론병 및 궤양성 대장염 임상시험 : 대조 임상시험에서 이 약 투여군과 대조군간의 ALT상 승은 유사하였다. 체중에 따라 조정된 유도 요법 후 체중에 따라 조정된 유지 요법(최대 52주)의 유효성과 안전성을 평가한 소아 크론병의 3상 임상시험에서, 시험대상자의 2.6%(5/192)에서 3 X ULN의 ALT 상승이 발생하였고, 이 중 4명은 베이스라인에서 면역억제제를 병용 투여하였 다. 건선 임상시험 : 건선에 대한 대조 임상시험에서, 투여군과 대조군간의 ALT 상승은 유사하 였다. 화농성 한선염 임상시험 : 화농선 한선염에 대한 대조 임상시험에서, 투여군의 0.3%와 대 조군의 0.6%에서 3 X ULN의 ALT 상승이 발생하였다. 소아 특발성 관절염 임상시험 : 4세~17세 다관절형 소아 특발성 관절염 환자와 6세~17세 골부착부위염 관절염 환자의 3상 대조 임상 시험에서, 투여군의 6.1%와 대조군의 1.3%에 서 3 X ULN의 ALT 상승이 발생하였다. 대부분의 ALT 상승은 메토트렉세이트 병용 사 용에 따라 발생하였다. 2세에서 4세 미만의 다관절형 소아 특발성 관절염 환자에 대한 3상 임상시험에서, 3 X ULN의 ALT 상승은 발생하지 않았다. 판상 건선 임상시험 : 판상 건선 소아 환자에 대한 3상 임상시험에서 3 X ULN의 ALT 상승은 발생하지 않았다. 모든 적응증의 임상시험에서 상승된 ALT를 나타내는 환자들은 증상이 없었고, 대부분 상승 이 일시적이며 투여 지속 시 소실되었다. 그러나 간부전을 포함한 중증의 간손상이 이 약을 포함한 TNF 저해제를 투여받은 환자의 시판 후 보고에서 아주 드물게 나타났다. 이 약 투 여와의 관계는 명백하지 않다. 10) 아자티오프린 또는 6-메르캅토푸린과의 병용 투여 : 성인 크론병 임상시험에서, 아자티오 프린/6-메르캅토푸린과 병용 투여 시 이 약의 단독 투여에 비해 악성 종양 및 심각한 감염 과 관련된 유해사례의 발생률이 더 높게 나타났다
16 11) 시판 후 조사 또는 4상 시험에서 보고된 추가 유해사례 : 4상 시험과 시판 후 조사에서 보고된 추가 유해사례는 다음 표 2와 같다. <표 2. 시판 후 조사 및 제4상 시험에서의 유해사례> 신체기관 유해사례 감염 및 기생충 감염 게실염 간담도계 이상 B형 간염의 재활성화, 간부전, 간염 신경계 이상 탈수초성 장애(예. 시신경염), 길랑-바레 증후군, 뇌혈관사고 호흡, 흉부 및 종격계 폐색전증, 흉막삼출, 폐섬유증 이상 피부 및 피하 조직 피부 혈관염, 스티븐스-존슨 증후군, 혈관부종, 건선의 발생 또는 악화 이상 (손발바닥 농포성 건선 포함), 다형홍반, 탈모 면역계 이상 아나필락시스, 사르코이드증 위장관계 이상 장 천공 양성, 악성 및 미확인 Hepatosplenic T-cell lymphoma, 백혈병, 메르켈세포암(피부 신경내분 신생물 비 선암) 근골격계 및 결합조직 루프스 유사 증후군 이상 심장 이상 심근경색증 전신 및 투여부위 이상 발열 12) 국내 시판 후 조사 결과 1 국내에서 6년 동안 류마티스 관절염, 건선성 관절염, 강직성 척추염, 크론병, 건선환자를 대상으로 실시한 시판 후 조사 국내에서 1,698명(류마티스 관절염 652명, 건선성 관절염 47명, 강직성 척추염 925명, 크 론병 73명, 건선 1명)을 대상으로 실시한 시판 후 사용성적조사 결과, 유해사례 발현율은 10.07%(171명/1,698명, 238건)이었고, 이 중 이 약과 인과관계를 배제할 수 없는 약물유 해반응 발현율은 6.83%(116명/1,698명, 141건)이며, 주사부위 반응 19건(1.11%), 가려움(증) 9건(0.53%), 발진 8건(0.47%), 대상포진, 상기도 감염, 두드러기 각 4건(0.24%), 신우신염, 홍 반, 복통, 어지러움, 두통 각 3건(0.18%), 연조직염, 폐결핵, 결핵성 복막염, 폐렴, 결핵, 피 부반응, 알레르기성 피부염, 림프종, 근육통, 기침, 림프절병증 각 2건(0.12%), 모낭염, 신 장결핵, 비염, 편도염, 말라리아, 기관지 폐렴, B형 간염, 코 인두염, 감염성 윤활낭염, 진균 성 감염, 크립토코쿠스 폐렴, 농포성 발진, 가려움 발진, 피부염, 탈모(증), 피부병변, 무력 (증), 구토, 설사, 복막염, 구역, 고창, 갑상선암, 기관지 신생물, 급성 골수성 백혈병, 골관 절염, 관절종창, 폐출혈, 콧물, 간손상, 간독성, 간기능 이상, 찔림 알레르기, 현기증, 월경 장애, 포도막염 각 1건(0.06%)이 보고되었다. 중대한 유해사례 발현율은 2.77%(47명/1,698명, 63건)이며, 신우신염, 복통이 각 4건이었 으며 폐렴, 폐 결핵, 대상포진, 결핵성 복막염, 결핵, 설사, 구토, 가려움(증)이 각각 2건이 며 그 외 신장결핵, 말라리아, 감염성 윤활낭염, 크립토코쿠스 폐렴, 항문 농양, 복막 농양,
17 결장염, 장관 천공, 복막염, 장관 경색, 장피부누공, 구역, 홍반, 발진, 대뇌출혈, 마비, 치 매, 골관절염, 강직성 척추염, 등 통증, 갑상선암, 급성 골수성 백혈병, 직장암, 무력(증), 발열, 통증, 추골 탈구, 골절, 폐 출혈, 호흡곤란, 무릎 수술, 소장 절제(술), 혈중 크레아티 닌 증가, 혈색소 감소, 간독성, 찔림 알레르기, 심근경색증, 빈혈, 탈수는 각 1건이 보고되 었다. 이 중 이 약과 인과관계를 배제할 수 없는 중대한 약물유해반응 발현율은 1.47%(25명/1,698명, 30건)이며, 신우신염 3건, 복통, 폐결핵, 대상포진, 결핵성 복막염, 결핵, 가려움(증) 각 2 건, 폐렴, 신장결핵, 말라리아, 감염성 윤활낭염, 크립토코쿠스 폐렴, 복막염, 홍반, 발진, 골 관절염, 갑상선암, 급성 골수성 백혈병, 폐출혈, 혈중 크레아티닌 증가, 간독성, 찔림 알레 르기 각 1건이 보고되었다. 예상하지 못한 유해사례 발현율은 3.24%(55명/1,698명, 61건)이며, 설사, 콧물 각 5건, 관절 종창, 포도막염 각 3건, 등 통증, 사지 통증, 감각 이상, 무력(증), 림프절병증 각 2 건, 결장염, 복막염, 장관 경색, 위장관 궤양, 장피부누공, 명치불쾌감, 치루, 고창, 모낭염, 비염, 편도염, 말라리아, 기관지 폐렴, 감염성 윤활낭염, 크립토코쿠스 폐렴, 농포성 발진, 항문 농양, 복막 농양, 경부 통증, 강직성 척추염, 대뇌출혈, 마비, 치매, 신경근병증, 기억 장애, 폐 출혈, 눈마름, 압통, 종양 절제(술), 간독성, 추골 탈구, 현기증, 피부병변은 각각 1건이 보고되었다. 이 중 이 약과 인과관계를 배제할 수 없는 예상하지 못한 약물유해반응 발현율은 1.24%(21명/1,698명, 21건)이며, 림프절병증은 2건, 설사, 복막염, 고창, 모낭염, 비염, 편 도염, 말라리아, 기관지 폐렴, 감염성 윤활낭염, 크립토코쿠스 폐렴, 농포성 발진, 관절 종창, 콧물, 폐 출혈, 포도막염, 무력(증), 간독성, 현기증, 피부병변은 각각 1건이 보고되었다. 중 대하고 예상하지 못한 유해사례 발현율은 1.12%(19명/1,698명, 20건)이며, 설사는 2건, 말라리아, 감염성 윤활낭염, 크립토코쿠스 폐렴, 항문 농양, 복막 농양, 결장염, 복막염, 장 관 경색, 장피부누공, 대뇌출혈, 마비, 치매, 강직성 척추염, 등 통증, 무력(증), 추골 탈구, 폐 출혈, 간독성은 각 1건이 보고되었고, 중대하고 예상하지 못한 약물유해반응 발현율은 0.35%(6명/1,698명, 6건)이며, 복막염, 말라리아, 감염성 윤활낭염, 크립토코쿠스 폐렴, 폐 출혈, 간독성 각 1건이 보고되었다. 4. 일반적 주의 1) 알레르기 반응 : 임상시험 동안 이 약의 피하주사로 인한 심각한 알레르기 반응은 드물게 보고되었다. 이 약 투여 후 아나필락시스를 포함한 중대한 알레르기 반응이 보고된 바 있 다. 만일 아나필락시스 반응이나 다른 심각한 알레르기 반응이 나타나면 이 약의 투여를 즉 시 중단하고 적절한 치료를 시작해야 한다. 2) 면역억제 : 이 약을 투여받은 64명의 류마티스 관절염 환자에 대한 시험에서 지연성 과민 반응의 억제, 면역글로불린 억제 또는 effector T-와 B세포, NK-세포, 단핵세포/대식세포 및 호중구의 수적 변화의 증거는 없었다. 3) 혈액학적 반응 : TNF 저해제에서 드물게 재생불량성빈혈을 포함한 범혈구감소증이 보고되 었다. 의학적으로 중요한 혈구감소증(예. 저혈소판혈증, 백혈구감소증)을 포함한 혈액계의 유해사례가 이 약에서 보고되었다. 이러한 보고의 이 약에 대한 원인 상관관계는 불분명하 다. 이 약을 투여하는 동안 혈액질환을 암시하는 징후 또는 증상(예, 지속적인 발열, 타박
18 상, 출혈, 창백)이 발현되는 경우 즉각적인 의학적 처치를 받도록 모든 환자를 교육해야 한 다. 심각한 혈액학적 이상이 확정된 환자는 이 약의 투여 중단을 고려해야 한다. 4) 예방접종 : 이 약 또는 위약을 투여한 226명의 성인 류마티스 관절염 환자에 대한 시험에 서 표준 23가 폐구균 백신과 3가 인플루엔자 백신에 대한 항체반응과 유사한 반응이 관찰 되었다. 이 약을 투여받은 환자에게 생백신을 투여한 경우 이에 의한 이차적인 감염 전파에 대한 이용 가능한 자료는 없다. 이 약을 투여 받고 있는 환자에게 생백신을 제외한 다른 백 신을 병용 투여할 수 있다. 5) 울혈성 심부전 : 다른 TNF 저해제를 사용한 임상시험에서 울혈성 심부전의 악화와 울혈성 심부전으로 인한 사망률 증가가 관찰되었다. 이 약을 투여받은 환자에서도 울혈성 심부전이 악화된 사례가 보고되었다. 경증 심부전(NYHA classi/ii) 환자에게 이 약 투여시 주의해야 하며 중등도 또는 중증 심부전 환자에게 투여해서는 안 된다. 울혈성 심부전이 새롭게 발생 하거나 증상이 악화된 환자의 경우 이 약의 투여를 중단해야 한다. 6) 자가면역 과정 : 이 약의 투여로 자가면역 항체가 형성될 수 있다. 이 약의 장기투여가 자 가면역질환 발생에 미치는 영향은 알려지지 않았다. 만일 이 약으로 치료 후 환자에게서 루 푸스양 징후를 암시하는 증상을 나타내고 dsdna에 대한 항체가 양성이라면 이 약의 투여 를 중지해야 한다. 7) 생물학적 DMARDs 또는 TNF 저해제와의 병용투여 : 에타너셉트(다른 TNF 저해제)와 아나 킨라를 병용 투여한 임상 시험에서 심각한 감염이 관찰되었으며, 에타너셉트 단독 요법에 비해 추가적인 유익성이 없었다. 에타너셉트와 아나킨라의 병용 시 관찰된 유해사례의 특성 때문에, 아나킨라와 다른 TNF 저해제와의 병용으로 인해 유사한 독성이 있을 수 있다. 이 약과 아나킨라의 병용 투여가 권장되지 않는다. 감염 및 기타 잠재적 약물학적 상호작용의 위험 증가 가능성으로 이 약과 다른 생물학적 DMARDs (예. 아나킨라 및 아바타셉트) 또는 다른 TNF 저해제와의 병용투여는 권장되지 않는다. 8) 수술 : 이 약을 투여받은 환자에서 수술 절차의 안전성 경험은 제한적이다. 만일 수술 절차 가 계획된다면 이 약의 긴 반감기를 고려해야 한다. 이 약 투여동안 수술이 필요한 환자는 감염에 대해 면밀히 모니터링하고 적절한 조치를 취해야 한다. 이 약 투여 동안 관절성형술 을 받는 환자에 대한 안전성 경험은 제한적이다. 9) 소장 폐색증 : 크론병의 치료에 반응하지 않은 환자는 외과적 치료를 요하는 고정된 섬유성 협착을 보일 수 있다. 이 약이 협착을 일으키거나 악화시키지 않는다는 것을 나타내는 자료 가 있다. 10) 간신장애 환자 : 이러한 환자군에 대해서 연구되지 않았으며 권장 용량이 없다. 11) 이 약이 운전이나 기계 조작 능력에 미치는 영향에 대해서는 연구된 바 없다. 5. 상호작용 1) 이 약은 류마티스 관절염 환자에서 단독요법 및 메토트렉세이트와의 병용 요법 모두에 대 해 연구되었다. 시험결과 이 약 또는 메토트렉세이트의 용량조절 필요성은 나타나지 않았 다. 공식적인 약동학 시험에서 이 약과 메토트렉세이트 이외의 약물과의 상호작용을 평가 하지 않았다. 임상시험에서 이 약과 일반적으로 사용되는 DMARDs(sulfasalazine, hydrochloroquine, leflunomide 및 parenteral gold), 글루코코르티코이드, 살리실산염, 비 스테로이드성항염증제 또는 진통제를 병용 투여 시 상호작용이 나타나지 않았다
19 이 약 단독투여에 비해 메토트렉세이트와 병용 투여 시 항체 생성률이 더 낮았다. 메토트 렉세이트를 투여하지 않고 이 약 단독투여시 항체 생성률과 이 약의 제거율이 증가했으며, 이 약의 효과는 감소했다. 2) 생백신과 이 약의 병용 투여는 권장되지 않는다. 3) 아나킨라와 이 약의 병용 투여는 권장되지 않는다. 4) 약물/실험실 검사 상호작용 : 이 약과 실험실 검사 사이에 알려진 간섭은 없다. 6. 임부 및 수유부에 대한 투여 1) 원숭이에 대한 발생독성시험에서 모체 독성, 배아 독성 또는 최기형성이 나타나지 않았다. 출생후 독성과 수태능에 미치는 영향에 대한 비임상시험 자료는 없다. TNF 알파 저해 작용 으로 인해 임신기간 중 이 약 투여는 신생아의 정상 면역반응에 영향을 줄 수 있다. 임신기 간 동안 이 약의 투여는 권장되지 않는다. 임신할 가능성이 있는 여성은 임신을 예방하기 위한 적절한 피임요법을 하며 이 약의 최종 투여 후 최소 5개월간 피임을 지속할 것이 강 력히 권장된다. 이 약에 노출된 임부의 임상 데이터는 제한적이다. 아달리무맙은 임신 중 아달리무맙으로 치료받은 여성에서 태반을 통과하여 태아의 혈청으 로 들어간다. 결과적으로 이 유아들은 감염의 위험이 증가될 수 있다. 자궁에서 아달리무맙 에 노출된 유아의 경우, 임신 중 이 약의 마지막 투여 후 5개월 동안 생백신 투여는 권장되 지 않는다. 2) 이 약의 모유로의 분비 여부 또는 섭취 후 전신적 흡수에 대해서는 알려지지 않았다. 그러 나 인간 면역글로불린이 모유로 분비되므로 수유부는 이 약의 최종 투여 후 최소 5개월간 수유를 해서는 안 된다. 7. 소아에 대한 투여 이 약은 소아 환자에 대해 연구되지 않았으므로 추가적인 자료를 얻을 때까지 18세 이하 소아 에 대한 투여는 권장되지 않는다[소아 특발성 관절염(다관절형 소아 특발성 관절염, 골부착부 위염 관련 관절염), 크론병(6-17세) 제외]. 8. 고령자에 대한 투여 이 약의 용량 조절이 요구되지 않는다. 이 약의 임상시험에 참가한 환자 중 65세 이상이 9.5%이고 75세 이상이 약 2.0%였으며 이들 환자군과 더 젊은 환자군 사이에 전반적인 유효 성의 차이는 관찰되지 않았다. 이 환자군에서 용량조절은 필요하지 않다. 9. 과량투여시의 처치 임상시험 중 용량제한독성은 관찰되지 않았다. 평가된 최고 용량은 10 mg/kg의 수회 정맥투 여였다. 과량투여의 경우 이상반응의 증상이나 징후 또는 효과를 모니터링하고 적절한 대증적 처치를 한다
20 10. 적용상의 주의사항 1) 주사방법에 대한 교육을 받은 후 환자가 자가주사할 경우, 자가주사 부위는 대퇴부 또는 복 부를 포함하며 주사부위는 교대로 바꿔야 한다. 새로운 주사부위는 앞서 주사한 부위에서 최소 3 cm 정도 떨어져서 주사한다. 2) 새로운 주사부위가 약하거나, 멍들거나, 충혈되거나 딱딱한 경우에는 투여해서는 안 된다. 투여 전 변색 및 이물질에 대해 육안으로 관찰한다. 주사액은 무색투명해야 하며, 주사액이 변색 또는 불투명하거나 이물이 있을 경우 투여하지 않는다. 펜형 제품의 경우 몸체에 있는 창(window)을 통해 확인한다. 주사 전 제품을 흔들거나 떨어뜨리지 않는다. 회색 뚜껑 및 색 뚜껑을 주사 직전에 제거한다. 3) 프리필드시린지 주사부위를 동봉된 알콜솜으로 닦는다. 주사바늘 덮개를 벗기고, 주사부위를 부드럽게 잡아 고정한 후 피부와 45도 각도로 주사한다. 4) 펜(pen) 형 1 주사부위를 동봉된 알콤솜으로 닦는다. 회색 뚜껑 및 색 뚜껑을 주사 직전에 제거한 다. 펜의 회색부분을 한손으로 잡는다. 펜의 회색 뚜껑(1) 및 색 뚜껑(2)에 손이 닿지 않도록 펜의 가운데를 손으로 잡는다. 회색 뚜껑(1)이 위로 향하도록 잡는다. 다른 손으로 회색 뚜껑(1)을 즉시 당겨서 제거한다. 작은 회색 주사바늘 커버와 덮개가 함께 제거되었는지 확인하며, 뚜껑을 다시 씌우면 안 된다. 주사침에서 몇 방울의 액이 나오는 것은 정상이다. 2 펜의 색 뚜껑(2)을 잡아당겨 벗긴 후 버린다. 색 작동 버튼이 노출되어 펜을 사 용할 준비가 된다. 약물이 방출될 수 있으므로, 적절한 주사위치를 잡기 전까지 색 작동 버튼을 누르거나 뚜껑을 다시 씌우면 안 된다. 3 한 손으로 주사부위의 깨끗한 피부를 아래 그림처럼 부드럽게 잡아 고정시킨다. 4 펜의 흰색 끝부분을 창이 보이도록 하여 피부와 직각(90도)이 되도록 놓는다. 창으로 보 여 지는 몇 방울의 기포는 정상이다. 5 펜의 몸체를 잡고 주사부위에 가볍게 눌러 주사준비를 한 다음 집게손가락 또는 엄지손 가락으로 주사기 윗부분의 색 버튼을 누른다. 바늘이 나올 때 나는 딸깍 소리가 들 리고, 바늘에 찔리는 따끔함이 느껴진다. 6 약 10초간 유지하여 완전히 주사되도록 한다. 7 주사 동안 노란색 표시가 펜의 창내로 이동하며, 노란색 표시의 이동이 멈추면 주사가 끝 난 것이다. 노란색 표시는 펜의 주사막대의 일부분이다. 노란색 표시가 창에 나타나지 않 는다면, 주사막대가 적절히 이동하지 않은 것이고, 주사가 완전히 이루어지지 않은 것이 다. 창(window) 주사 완료 후 노란 색 표시가 나타남 5) 이 약의 주사기에 다른 약물을 혼합해서는 안 된다. 사용하지 않고 남은 부분은 버린다. 일
21 회용이며 재사용하지 않는다. 어린이의 손이 닿지 않는 곳에 보관한다. 11. 저장상의 주의사항 이 약은 동결을 피하여 냉장 보관(2-8 )한다. 사용 전까지 포장을 뜯지 않고 용기 상자 내 부에 보관한다. 이 약은 1회에 한하여 25 이하에서 14일간 보관할 수 있으며, 빛을 피하여 보관하여야 한다. 실온 보관되었던 제품은 다시 냉장 보관해서는 안 된다. 25 이하에서 보관 시, 14일 내 사용되지 않은 약은 폐기하여야 한다. 12. 기타 이 약은 류마티스 관절염 환자에 대한 한 건의 이중 눈가림 후 공개연장 임상시험에서 최대 60 개월까지 투여되었다. 60개월까지의 투여기간 동안 류마티스 관절염의 증상과 징후를 감소시 키는 효과가 유지되었고 관절손상 진행속도 감소와 신체활동기능 향상 효과가 유지되었으며, 전반적으로 안전하고 내약성이 좋았다
젤잔즈정의 복용을 시작하기 전에 다음과 같은 감염 또는 감염 증상이 있는 경우 의료전문가에게 알리십시오: 열, 발한 또는 오한 피부의 열, 붉어짐 또는 통증이나 근육통 신체상의 상처 기침 설사 또는 복통 호흡이 짧아짐 소변을 볼 때 화끈거리는 느낌 피가 섞인 가래 또는
 부록 D: 복약 안내서 복약 안내서 젤잔즈 정 5 밀리그램 (토파시티닙시트르산염) 젤잔즈정 사용을 시작하기 전과 매 처방 시 이 복약 안내서를 참조하십시오. 새로운 최신 정보가 포함될 수 있습니다. 그러나 이 복약 안내서가 개인의 의학적 상태 또는 치료 내용에 대한 의료전문가와의 직접적인 상담을 대신할 수는 없습니다. 젤잔즈정에 대해 알아야 하는 가장 중요한
부록 D: 복약 안내서 복약 안내서 젤잔즈 정 5 밀리그램 (토파시티닙시트르산염) 젤잔즈정 사용을 시작하기 전과 매 처방 시 이 복약 안내서를 참조하십시오. 새로운 최신 정보가 포함될 수 있습니다. 그러나 이 복약 안내서가 개인의 의학적 상태 또는 치료 내용에 대한 의료전문가와의 직접적인 상담을 대신할 수는 없습니다. 젤잔즈정에 대해 알아야 하는 가장 중요한
11-orencia-sc-pi
 오렌시아서브큐프리필드시린지 125 밀리그램 ( 아바타셉트 ) 성분 함량 이약 1 프리필드시린지 (1mL) 중주성분 : 아바타셉트 ( 별규 ) 125.875mg 안정 ( 화 ) 제 : 백당 (NF) 171.19mg 폴록사머 188(NF), 인산이수소나트륨일수화물 (USP), 인산수소나트륨 ( 무수 )(USP) 용제 : 주사용수 (USP) 부착물 : 1 회용주사침
오렌시아서브큐프리필드시린지 125 밀리그램 ( 아바타셉트 ) 성분 함량 이약 1 프리필드시린지 (1mL) 중주성분 : 아바타셉트 ( 별규 ) 125.875mg 안정 ( 화 ) 제 : 백당 (NF) 171.19mg 폴록사머 188(NF), 인산이수소나트륨일수화물 (USP), 인산수소나트륨 ( 무수 )(USP) 용제 : 주사용수 (USP) 부착물 : 1 회용주사침
허가사항변경지시 ( 재심사 ) 에따른공고 _ 비다자 주 항상저희세엘진을아껴주시는여러선생님들께감사드립니다. 식품의약품안전처에서는공문 의약품안전평가과-2409 ( ) 에의해아래제품의사용상의주의사항을변경토록지시하였습니다. 이에따라해당제품의제품설명서가 2017
 허가사항변경지시 ( 재심사 ) 에따른공고 _ 비다자 주 항상저희세엘진을아껴주시는여러선생님들께감사드립니다. 식품의약품안전처에서는공문 의약품안전평가과-2409 (2017.04.26) 에의해아래제품의사용상의주의사항을변경토록지시하였습니다. 이에따라해당제품의제품설명서가 2017 년 05 월 26 일자로변경되었음을알려드리고자합니다. 해당제품 : 비다자주 ( 아자시티딘
허가사항변경지시 ( 재심사 ) 에따른공고 _ 비다자 주 항상저희세엘진을아껴주시는여러선생님들께감사드립니다. 식품의약품안전처에서는공문 의약품안전평가과-2409 (2017.04.26) 에의해아래제품의사용상의주의사항을변경토록지시하였습니다. 이에따라해당제품의제품설명서가 2017 년 05 월 26 일자로변경되었음을알려드리고자합니다. 해당제품 : 비다자주 ( 아자시티딘
Jksvs019(8-15).hwp
 Grade I Grade II Grade III 12 대한혈관외과학회지 : 제 20 권 제 1 호 2004 Control Group A Group B Fig. 4. Microscopic findings of vein wall in control, group A and group B on the day of 7 after venous occlusion. The
Grade I Grade II Grade III 12 대한혈관외과학회지 : 제 20 권 제 1 호 2004 Control Group A Group B Fig. 4. Microscopic findings of vein wall in control, group A and group B on the day of 7 after venous occlusion. The
Jkafm093.hwp
 가정의학회지 2004;25:721-739 비만은 심혈관 질환, 고혈압 및 당뇨병에 각각 위험요인이고 다양한 내과적, 심리적 장애와 연관이 있는 질병이다. 체중감소는 비만한 사람들에 있어 이런 위험을 감소시키고 이들 병발 질환을 호전시킨다고 알려져 있고 일반적으로 많은 사람들에게 건강을 호전시킬 것이라는 믿음이 있어 왔다. 그러나 이런 믿음을 지지하는 연구들은
가정의학회지 2004;25:721-739 비만은 심혈관 질환, 고혈압 및 당뇨병에 각각 위험요인이고 다양한 내과적, 심리적 장애와 연관이 있는 질병이다. 체중감소는 비만한 사람들에 있어 이런 위험을 감소시키고 이들 병발 질환을 호전시킨다고 알려져 있고 일반적으로 많은 사람들에게 건강을 호전시킬 것이라는 믿음이 있어 왔다. 그러나 이런 믿음을 지지하는 연구들은
질병 1 유병자 2 20 ~ 30대 환자 3 발생률 4 남성의 발생률 5 소아 발생률 6 환자 5년 생존율 7 고혈압 환자 8 뇌경색증 진료 인원 9 치매 증가율 치료비 1 소아 진료비 2 노인 월평균 진료비 사망 1 폐 사망률 2 3대 사망원인 3 여성 10대 사인
 숫자로 보는 질병과 건강 질병 1 유병자 2 20 ~ 30대 환자 3 발생률 4 남성의 발생률 5 소아 발생률 6 환자 5년 생존율 7 고혈압 환자 8 뇌경색증 진료 인원 9 치매 증가율 치료비 1 소아 진료비 2 노인 월평균 진료비 사망 1 폐 사망률 2 3대 사망원인 3 여성 10대 사인 4 연령별 사망원인 5 남성의 자살률 6 환자 보호자 우울증 10
숫자로 보는 질병과 건강 질병 1 유병자 2 20 ~ 30대 환자 3 발생률 4 남성의 발생률 5 소아 발생률 6 환자 5년 생존율 7 고혈압 환자 8 뇌경색증 진료 인원 9 치매 증가율 치료비 1 소아 진료비 2 노인 월평균 진료비 사망 1 폐 사망률 2 3대 사망원인 3 여성 10대 사인 4 연령별 사망원인 5 남성의 자살률 6 환자 보호자 우울증 10
공용심폐소생술00
 iii iv v vi vii ix x xi Part I 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Part II 18 19 제 1부 심정지의 이해와 심폐소생술 지침의 주요내용 20 21 22 23 24 25 26 27 28 29 제 2부 심폐소생술과 관련된 윤리 30 31 32 33 34 35 제 3부 기본 소생술 제1장 제2장
iii iv v vi vii ix x xi Part I 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Part II 18 19 제 1부 심정지의 이해와 심폐소생술 지침의 주요내용 20 21 22 23 24 25 26 27 28 29 제 2부 심폐소생술과 관련된 윤리 30 31 32 33 34 35 제 3부 기본 소생술 제1장 제2장
- HIV 감염, 백혈병, 림프종, Hodgkin 병, 다발성골수종, 전신암, 만성신부전또는신증후군이 있는 2 세이상의사람 ; 면역억제요법 ( 코르티코스테로이드등 ) 중인사람 ; 장기또는 골수이식환자 ( 특정그룹에대해서는용법 용량의특정접종시기참조 ) 재접종 23가폴리사
 프로디악스 -23 프리필드시린지 ( 폐렴구균백신 ) 원료약품및분량 1 프리필드시린지 (0.5 밀리리터 ) 중, 주성분 : 다음 각각의 폐렴구균 협막형으로부터 추출된 정제 협막 폴리사카라이드 ( 협막형 : 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F,
프로디악스 -23 프리필드시린지 ( 폐렴구균백신 ) 원료약품및분량 1 프리필드시린지 (0.5 밀리리터 ) 중, 주성분 : 다음 각각의 폐렴구균 협막형으로부터 추출된 정제 협막 폴리사카라이드 ( 협막형 : 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F,
류마티스 질환의 이해와 관리
 류마티스관절염의이해 대구가톨릭대학교병원 류마티스내과 최정윤 류마티스란? 류마 ( 나쁜氣 ) B.C. 2,400 류마티스질환의종류 류마티스관절염 전신성홍반성루푸스 쇼그렌증후군 강직성척추염 베체트병 경피증 섬유근통등 100가지가넘는질환 관절염 류마티스관절염 골관절염 ( 퇴행성관절염 ) 강직성척추염 통풍성관절염 건선관절염등 100가지가넘는질환 류마티스 관절염 관절의구조
류마티스관절염의이해 대구가톨릭대학교병원 류마티스내과 최정윤 류마티스란? 류마 ( 나쁜氣 ) B.C. 2,400 류마티스질환의종류 류마티스관절염 전신성홍반성루푸스 쇼그렌증후군 강직성척추염 베체트병 경피증 섬유근통등 100가지가넘는질환 관절염 류마티스관절염 골관절염 ( 퇴행성관절염 ) 강직성척추염 통풍성관절염 건선관절염등 100가지가넘는질환 류마티스 관절염 관절의구조
암센터뉴스레터1
 CANCER HOSPITAL News News Letter For Yonsei University Gangnam Severance Hospital http://gs.iseverance.com 2012.06.21 2012.08.16 2012.09.19 2012.10.04 2012.10.25 CONTENTS 2012.07.27 2012.10.06 2012.11.06
CANCER HOSPITAL News News Letter For Yonsei University Gangnam Severance Hospital http://gs.iseverance.com 2012.06.21 2012.08.16 2012.09.19 2012.10.04 2012.10.25 CONTENTS 2012.07.27 2012.10.06 2012.11.06
젤잔즈정을투여하는경우대상포진에걸릴위험이높아질수있습니다. 젤잔즈정의복용을시작하기전에다음과같은감염또는감염증상이있는경우의료전문가와 상의하십시오 열, 발한또는오한 피부의열, 붉어짐또는통증이나 근육통 신체상의상처 기침 설사또는복통 호흡이짧아짐 소변을볼때화끈거리는느낌 피가섞인가래
 부록 D: 복약안내서 복약안내서 젤잔즈 정 5 밀리그램 ( 토파시티닙시트르산염 ) 젤잔즈정사용을시작하기전과매처방시이복약안내서를참조하십시오. 새로운최신정보가 포함될수있습니다. 그러나이복약안내서가개인의의학적상태또는치료내용에대한 의료전문가와의직접적인상담을대신할수는없습니다. 젤잔즈정에대해알아야할중요한정보는무엇입니까? 젤잔즈정은복용하는환자에서다음과같은중대한부작용이나타날수있습니다.
부록 D: 복약안내서 복약안내서 젤잔즈 정 5 밀리그램 ( 토파시티닙시트르산염 ) 젤잔즈정사용을시작하기전과매처방시이복약안내서를참조하십시오. 새로운최신정보가 포함될수있습니다. 그러나이복약안내서가개인의의학적상태또는치료내용에대한 의료전문가와의직접적인상담을대신할수는없습니다. 젤잔즈정에대해알아야할중요한정보는무엇입니까? 젤잔즈정은복용하는환자에서다음과같은중대한부작용이나타날수있습니다.
 2 0 1 2 3 2012 1 2 Part I. 1-1 1-2 1-3 1-4 1-5 1-6 1-7 1-8 Part II. 2-1 2-2 2-3 2-4 2-5 2-6 2-7 2-8 2-9 2-10 2-11 2-12 2-13 2-14 2-15 2-16 2-17 2-18 2-19 2-20 2-21 2-22 2-23 2-24 2-25 2-26 2-27 2-28
2 0 1 2 3 2012 1 2 Part I. 1-1 1-2 1-3 1-4 1-5 1-6 1-7 1-8 Part II. 2-1 2-2 2-3 2-4 2-5 2-6 2-7 2-8 2-9 2-10 2-11 2-12 2-13 2-14 2-15 2-16 2-17 2-18 2-19 2-20 2-21 2-22 2-23 2-24 2-25 2-26 2-27 2-28
이백신은 A 형간염바이러스에대한면역이없는사람에게접종이권장된다. A 형간염 바이러스항체가없는소아나일부성인의경우에감염의위험성이높아지는다음의경우에 접종이권장된다. - A형간염의풍토성이높은지역으로여행하는경우 ( 미국, 캐나다, 서유럽, 북유럽, 일본, 호주, 뉴질랜드이외의나라
 박타 주 프리필드시린지 (A 형간염백신 ) 원료약품및분량 1 바이알 / 프리필드시린지 1 밀리리터중, 주성분 : 정제불활화 A형간염바이러스 ( 별규 ) -----------------------------50 U ( 바이러스주 : CR326F, 세포주 : MRC-5) 기타첨가제 : 수산화알루미늄비결정인산황산염 --------------------------0.45
박타 주 프리필드시린지 (A 형간염백신 ) 원료약품및분량 1 바이알 / 프리필드시린지 1 밀리리터중, 주성분 : 정제불활화 A형간염바이러스 ( 별규 ) -----------------------------50 U ( 바이러스주 : CR326F, 세포주 : MRC-5) 기타첨가제 : 수산화알루미늄비결정인산황산염 --------------------------0.45
(지도6)_(5단원 156~185)
 1 _ 2_ 3_ 4_ 01 158 159 참고 자료 160 161 162 163 02 164 165 참고 자료 166 167 168 169 활 동 지 03 170 171 172 173 활동의 결과이다. 신경 세포와 신경 세포 간에 화학 물질을 방출하여 전기 신호를 전달해 주는 시냅스 활동은 우리 뇌가 새로운 경험을 할 때마다 변한다. 기분 나쁜 경험을 하면
1 _ 2_ 3_ 4_ 01 158 159 참고 자료 160 161 162 163 02 164 165 참고 자료 166 167 168 169 활 동 지 03 170 171 172 173 활동의 결과이다. 신경 세포와 신경 세포 간에 화학 물질을 방출하여 전기 신호를 전달해 주는 시냅스 활동은 우리 뇌가 새로운 경험을 할 때마다 변한다. 기분 나쁜 경험을 하면
치료기간을연장할수있다. 이러한환자들에는주기적인치료를고려할수있으며, 잠재적 유익성과이약의장기사용에의한악성종양의발생의위험증가등을고려하여사용하도록 한다 ( 사용상의주의사항 참조 ). 사용상의주의사항 1. 경고골관절염및골다공증환자를대상으로수행된임상시험분석결과위약대조군에비해이약
 마야칼식나살스프레이 ( 살카토닌 ) - 200 I.U. Miacalcic nasal spray (salcatonin) 마야칼식나살스프레이 200 ( 살카토닌 ) 원료약품의분량 1mL 중주성분 : 살카토닌 (EP)...2,200 IU 성상 이약은무색투명한액으로, 일정량씩분무되는용기에들어있다. 효능 효과 1. 만성고칼슘혈증의치료 ( 유방, 폐, 신장또는기타악성종양또는골수종에따른종양성골용해,
마야칼식나살스프레이 ( 살카토닌 ) - 200 I.U. Miacalcic nasal spray (salcatonin) 마야칼식나살스프레이 200 ( 살카토닌 ) 원료약품의분량 1mL 중주성분 : 살카토닌 (EP)...2,200 IU 성상 이약은무색투명한액으로, 일정량씩분무되는용기에들어있다. 효능 효과 1. 만성고칼슘혈증의치료 ( 유방, 폐, 신장또는기타악성종양또는골수종에따른종양성골용해,
조스타박스주(대상포진생바이러스백신)
 조스타박스주 ( 대상포진생바이러스백신 ) 원료약품및분량 1 바이알 (0.65 밀리리터 ) 중주성분 : 약독수두생바이러스 ( 별규 ) ----------------------------------- 19400 PFU 이상 ( 바이러스주 : Oka/Merck 주, 세포주 : MRC-5) 첨가제 ( 안정제 ): 백당 -------------------------------------------------------------------------
조스타박스주 ( 대상포진생바이러스백신 ) 원료약품및분량 1 바이알 (0.65 밀리리터 ) 중주성분 : 약독수두생바이러스 ( 별규 ) ----------------------------------- 19400 PFU 이상 ( 바이러스주 : Oka/Merck 주, 세포주 : MRC-5) 첨가제 ( 안정제 ): 백당 -------------------------------------------------------------------------
회원번호 대표자 공동자 KR000****1 권 * 영 KR000****1 박 * 순 KR000****1 박 * 애 이 * 홍 KR000****2 김 * 근 하 * 희 KR000****2 박 * 순 KR000****3 최 * 정 KR000****4 박 * 희 조 * 제
 회원번호 대표자 공동자 KR000****1 권 * 영 KR000****1 박 * 순 KR000****1 박 * 애 이 * 홍 KR000****2 김 * 근 하 * 희 KR000****2 박 * 순 KR000****3 최 * 정 KR000****4 박 * 희 조 * 제 KR000****4 설 * 환 KR000****4 송 * 애 김 * 수 KR000****4
회원번호 대표자 공동자 KR000****1 권 * 영 KR000****1 박 * 순 KR000****1 박 * 애 이 * 홍 KR000****2 김 * 근 하 * 희 KR000****2 박 * 순 KR000****3 최 * 정 KR000****4 박 * 희 조 * 제 KR000****4 설 * 환 KR000****4 송 * 애 김 * 수 KR000****4
썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1정 (300mg) 중티아프로펜산 (BP) 200mg [ 성상 ] 백색또는미황색의원형정제 [ 효능효과 ] 류마
![썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1정 (300mg) 중티아프로펜산 (BP) 200mg [ 성상 ] 백색또는미황색의원형정제 [ 효능효과 ] 류마 썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1정 (300mg) 중티아프로펜산 (BP) 200mg [ 성상 ] 백색또는미황색의원형정제 [ 효능효과 ] 류마](/thumbs/103/158619173.jpg) 썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1정 (300mg) 중티아프로펜산 (BP) 200mg [ 성상 ] 백색또는미황색의원형정제 [ 효능효과 ] 류마티양관절염, 골관절염 ( 퇴행성관절질환 ), 강직성척추염, 요통, 견관절 ( 어깨관절 ) 주위염,
썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1정 (300mg) 중티아프로펜산 (BP) 200mg [ 성상 ] 백색또는미황색의원형정제 [ 효능효과 ] 류마티양관절염, 골관절염 ( 퇴행성관절질환 ), 강직성척추염, 요통, 견관절 ( 어깨관절 ) 주위염,
35-11A.hwp
 윤 석 원* 김 동 관* 김 정 원* 박 창 률* 김 용 희* 박 기 성* 박 승 일* =Abstract= Video Assisted Thoracic Surgery(VATS) of Pericardial Window Operation Seok Won Youn, M.D.*, Dong Kwan Kim, M.D.*, Jeong Won Kim, M.D.* Chang
윤 석 원* 김 동 관* 김 정 원* 박 창 률* 김 용 희* 박 기 성* 박 승 일* =Abstract= Video Assisted Thoracic Surgery(VATS) of Pericardial Window Operation Seok Won Youn, M.D.*, Dong Kwan Kim, M.D.*, Jeong Won Kim, M.D.* Chang
1. 경고골관절염및골다공증환자를대상으로수행된임상시험분석결과위약대조군에비해이약투여군에서암발생률이통계적으로유의하게증가하였다. 이들임상시험에서위약대조군과비교하여이약의장기투여환자에서의절대적암발생위험률은 0.7 ~ 2.4% 로나타났다. 이들임상시험에서환자들은경구또는비강내투여제제
 마야칼식나살스프레이 ( 살카토닌 ) - 200 I.U. Miacalcic nasal spray (salcatonin) 마야칼식나살스프레이 200 ( 살카토닌 ) 원료약품의분량 1mL 중주성분 : 살카토닌 (EP)...2,200 IU 성상 이약은무색투명한액으로, 일정량씩분무되는용기에들어있다. 효능 효과다른치료법에반응하지않거나다른치료법이적절하지않은 ( 예, 중증신장애환자
마야칼식나살스프레이 ( 살카토닌 ) - 200 I.U. Miacalcic nasal spray (salcatonin) 마야칼식나살스프레이 200 ( 살카토닌 ) 원료약품의분량 1mL 중주성분 : 살카토닌 (EP)...2,200 IU 성상 이약은무색투명한액으로, 일정량씩분무되는용기에들어있다. 효능 효과다른치료법에반응하지않거나다른치료법이적절하지않은 ( 예, 중증신장애환자
 - 1 - - 2 - - 3 - 1 1 1. 연구목적 2. 연구필요성 - 4 - - 5 - - 6 - - 7 - 2-8 - 3 1. 브루셀라증 - 9 - (2006 5 12 ) ( ) (%) : (2007) (2007 112008 1 ) - 10 - 2. 큐열 9. (2009, ) (2007 112008 1 ) - 11 - 3. 장출혈성대장균감염증 - 12
- 1 - - 2 - - 3 - 1 1 1. 연구목적 2. 연구필요성 - 4 - - 5 - - 6 - - 7 - 2-8 - 3 1. 브루셀라증 - 9 - (2006 5 12 ) ( ) (%) : (2007) (2007 112008 1 ) - 10 - 2. 큐열 9. (2009, ) (2007 112008 1 ) - 11 - 3. 장출혈성대장균감염증 - 12
- 2 -
 - 1 - - 2 - - - - 4 - - 5 - - 6 - - 7 - - 8 - 4) 민원담당공무원 대상 설문조사의 결과와 함의 국민신문고가 업무와 통합된 지식경영시스템으로 실제 운영되고 있는지, 국민신문 고의 효율 알 성 제고 등 성과향상에 기여한다고 평가할 수 있는지를 치 메 국민신문고를 접해본 중앙부처 및 지방자 였 조사를 시행하 였 해 진행하 월 다.
- 1 - - 2 - - - - 4 - - 5 - - 6 - - 7 - - 8 - 4) 민원담당공무원 대상 설문조사의 결과와 함의 국민신문고가 업무와 통합된 지식경영시스템으로 실제 운영되고 있는지, 국민신문 고의 효율 알 성 제고 등 성과향상에 기여한다고 평가할 수 있는지를 치 메 국민신문고를 접해본 중앙부처 및 지방자 였 조사를 시행하 였 해 진행하 월 다.
조스타박스주(대상포진생바이러스백신)
 인트론에이멀티도스펜 ( 인터페론알파 -2b, 유전자재조합 ) 원료약품및분량 1 ml 중 (1.2ml/ 펜 ) 주성분 : 인터페론알파-2B ( 별규 ) -----------------------------15 10 6 I.U.(1천8백만단위 ) ----------------------------------25 10 6 I.U.(3천만단위 ) 첨가제 ( 보존제
인트론에이멀티도스펜 ( 인터페론알파 -2b, 유전자재조합 ) 원료약품및분량 1 ml 중 (1.2ml/ 펜 ) 주성분 : 인터페론알파-2B ( 별규 ) -----------------------------15 10 6 I.U.(1천8백만단위 ) ----------------------------------25 10 6 I.U.(3천만단위 ) 첨가제 ( 보존제
년암발생자수는 년대비 명이증가하여 년의 년 대비암발생자수증가 명증가 와비교하여둔화되었다 모든암연도별연령표준화발생률추이 모든암의조발생률은 년 만명당 명으로 년 만 명당 명과비교하여 명증가하였다 남자의조발생률은 년과비교하여 만명당 명증가하였 으며 여자의조발생률은 년과비교하
 [1] 2012 년암발생통계분석결과암환자수 3,912 명증가, 2011 년대비암발생률증가둔화 2011 년대비간암 폐암 자궁경부암의발생률감소 년신규암환자수는남자 명 여자 명으로총 명으로집계되었다 남녀를합해 년에가장많이발생한암은갑상선암이었으며 다음으로위암 대장암 폐암 유방암 간암 전립선암순으로많이 발생한것으로나타났다 순위 전체남자여자 암종발생자수분율암종발생자수분율암종
[1] 2012 년암발생통계분석결과암환자수 3,912 명증가, 2011 년대비암발생률증가둔화 2011 년대비간암 폐암 자궁경부암의발생률감소 년신규암환자수는남자 명 여자 명으로총 명으로집계되었다 남녀를합해 년에가장많이발생한암은갑상선암이었으며 다음으로위암 대장암 폐암 유방암 간암 전립선암순으로많이 발생한것으로나타났다 순위 전체남자여자 암종발생자수분율암종발생자수분율암종
두부백선은주로소아에서나타난다. 감염의재발을막기위해서는규칙적으로적절히정해진기간동안치료해야한다. 1) 체중 20 kg 미만 (5 세미만 ) : 1 회 62.5 mg, 1 일 1 회투여한다. 투여경험이부족하므로, 치료의유익성과위험성을고려해서투여여부를결정해야한다. 2) 체중
 라미실정 125mg ( 테르비나핀염산염 ) - 125mg Lamisil Tab. (terbinafine HCl) 원료약품의분량 1 정중테르비나핀염산염 ( 별규 )... 140.625 mg ( 테르비나핀으로서 125 mg ) 성상 흰색내지연한노란색의원형정제 효능 효과 1. 성인 1) 피부사상균에의한다음의피부진균증 : 족부백선, 체부백선, 고부백선 ( 완선 )
라미실정 125mg ( 테르비나핀염산염 ) - 125mg Lamisil Tab. (terbinafine HCl) 원료약품의분량 1 정중테르비나핀염산염 ( 별규 )... 140.625 mg ( 테르비나핀으로서 125 mg ) 성상 흰색내지연한노란색의원형정제 효능 효과 1. 성인 1) 피부사상균에의한다음의피부진균증 : 족부백선, 체부백선, 고부백선 ( 완선 )
용법ㆍ용량 주입방법이약은희석하여별도의전용관을써서정맥점적주입하며, 외래환자의치료에적합하다. 매회이약점적투여 분전에해열제 ( 아세트아미노펜등 ) 및항히스타민제 ( 디펜히드라민등 ) 를투여하여야한다. 비호지킨림프종및만성림프구성백혈병환자의치료계획중글루코코르티코이드가
 주 ( 리툭시맙 ) 단클론항체, 유전자재조합 ) / 전문의약품 원료약품및그분량 이약 1 밀리리터중 주성분 : 리툭시맙 ( 별규 )... 10.0mg 안정 ( 화 ) 제 : 폴리소르베이트 80... 0.7mg 완충제 : 시트르산나트륨 등장화제 : 염화나트륨 ph 조정제 : 수산화나트륨 ph 조정제 : 염산 용제 : 주사용수 성상 무색또는미황색용액이충전된바이알주사제
주 ( 리툭시맙 ) 단클론항체, 유전자재조합 ) / 전문의약품 원료약품및그분량 이약 1 밀리리터중 주성분 : 리툭시맙 ( 별규 )... 10.0mg 안정 ( 화 ) 제 : 폴리소르베이트 80... 0.7mg 완충제 : 시트르산나트륨 등장화제 : 염화나트륨 ph 조정제 : 수산화나트륨 ph 조정제 : 염산 용제 : 주사용수 성상 무색또는미황색용액이충전된바이알주사제
제품설명서Template
 전문의약품, 국가출하승인의약품 프리베나13주 (폐렴구균 씨알엠(CRM197) 단백접합백신) [원료약품의 분량] 이 약 1 프리필드시린지 (0.5 ml) 중 주성분: 정제폐렴구균폴리사카라이드 (혈청형 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F) 디프테리아 CRM197 단백질 접합체 (균주:S.pneumoniae
전문의약품, 국가출하승인의약품 프리베나13주 (폐렴구균 씨알엠(CRM197) 단백접합백신) [원료약품의 분량] 이 약 1 프리필드시린지 (0.5 ml) 중 주성분: 정제폐렴구균폴리사카라이드 (혈청형 1, 3, 4, 5, 6A, 6B, 7F, 9V, 14, 18C, 19A, 19F, 23F) 디프테리아 CRM197 단백질 접합체 (균주:S.pneumoniae
조스타박스주(대상포진생바이러스백신)
 키트루다 주 ( 펨브롤리주맙, 유전자재조합 ) 원료약품및분량 1 바이알 (4.0 밀리리터 ) 중, 유효성분 : 펨브롤리주맙 ( 유전자재조합 ) ( 별규 ) ------------ 100.0 밀리그램 ( 숙주세포 : CHO DXB11, 벡터 : papd11v1-ga) 첨가제 ( 안정제 ) 폴리소르베이트 80 --------------- 0.8 밀리그램 첨가제
키트루다 주 ( 펨브롤리주맙, 유전자재조합 ) 원료약품및분량 1 바이알 (4.0 밀리리터 ) 중, 유효성분 : 펨브롤리주맙 ( 유전자재조합 ) ( 별규 ) ------------ 100.0 밀리그램 ( 숙주세포 : CHO DXB11, 벡터 : papd11v1-ga) 첨가제 ( 안정제 ) 폴리소르베이트 80 --------------- 0.8 밀리그램 첨가제
.....6.ok.
 Ⅳ 성은 인간이 태어난 직후부터 시작되어 죽는 순간까지 계속되므로 성과 건강은 불가분의 관계이다. 청소년기에 형성된 성가치관은 평생의 성생활에 영향을 미치며 사회 성문화의 토대가 된다. 그러므로 성과 건강 단원에서는 생명의 소중함과 피임의 중요성을 알아보고, 성매매와 성폭력의 폐해, 인공임신 중절 수술의 부작용 등을 알아봄으로써 학생 스스로 잘못된 성문화를
Ⅳ 성은 인간이 태어난 직후부터 시작되어 죽는 순간까지 계속되므로 성과 건강은 불가분의 관계이다. 청소년기에 형성된 성가치관은 평생의 성생활에 영향을 미치며 사회 성문화의 토대가 된다. 그러므로 성과 건강 단원에서는 생명의 소중함과 피임의 중요성을 알아보고, 성매매와 성폭력의 폐해, 인공임신 중절 수술의 부작용 등을 알아봄으로써 학생 스스로 잘못된 성문화를
2017 일반건강검진표_1220
 2018년 일반건강검진 안내 최근 10년간 본인의 검진결과 확인 건강정보전문 포털사이트 (http://hi.nhis.or.kr/건강검진) 국민건강보험 모바일 앱 (M건강보험/검진결과 조회) 건강검진 주의사항 빠르고 정확한 검진을 위하여 반드시 주의사항을 확인하시고 검진 받으시기 바랍니다. 01. 금식 03. 문진표 작성 검진 전날 저녁 9시 이후에는 금식하시기
2018년 일반건강검진 안내 최근 10년간 본인의 검진결과 확인 건강정보전문 포털사이트 (http://hi.nhis.or.kr/건강검진) 국민건강보험 모바일 앱 (M건강보험/검진결과 조회) 건강검진 주의사항 빠르고 정확한 검진을 위하여 반드시 주의사항을 확인하시고 검진 받으시기 바랍니다. 01. 금식 03. 문진표 작성 검진 전날 저녁 9시 이후에는 금식하시기
<32303131B3E25FBBE7B8C1BFF8C0CEC5EBB0E85FB0E1B0FA287638295F6D303930372832303132303931322928C3D6C1BE292E687770>
 http://kostat.go.kr 2012. 9. 13(목) 12:00부터 사용하시기 바랍니다. 보도자료 배포일시 2012. 9. 13(목) 08:30 담당부서 담 당 자 사회통계국 인구동향과 과 장 : 서 운 주 (042.481.2250) 사무관 : 류 성 옥 (042.481.2251) 2011년 사망원인통계 일 러 두 기 이 자료는 통계법과 가족관계등록
http://kostat.go.kr 2012. 9. 13(목) 12:00부터 사용하시기 바랍니다. 보도자료 배포일시 2012. 9. 13(목) 08:30 담당부서 담 당 자 사회통계국 인구동향과 과 장 : 서 운 주 (042.481.2250) 사무관 : 류 성 옥 (042.481.2251) 2011년 사망원인통계 일 러 두 기 이 자료는 통계법과 가족관계등록
조스타박스주(대상포진생바이러스백신)
 박타프리필드시린지 (A 형간염백신 ) 원료약품및분량 1 프리필드시린지 1 밀리리터중, 주성분 : 정제불활화 A형간염바이러스 ( 별규 ) ------------------------------50U ( 바이러스주 : CR326F, 세포주 : MRC-5) 기타첨가제 : 수산화알루미늄비결정인산황산염 ---------------------------0.45mg (
박타프리필드시린지 (A 형간염백신 ) 원료약품및분량 1 프리필드시린지 1 밀리리터중, 주성분 : 정제불활화 A형간염바이러스 ( 별규 ) ------------------------------50U ( 바이러스주 : CR326F, 세포주 : MRC-5) 기타첨가제 : 수산화알루미늄비결정인산황산염 ---------------------------0.45mg (
77
 76 77 1. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 78 2. 1 2 3 4 5 6 7 8 9 10 11 12 79 80 II 81 82 II 83 84 II 85 86 II 87 s t r e t c h i n g 88 II 89 90 II 91 d a n c e s p o r t s 92 II 93 ;4#; 94 II
76 77 1. 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 78 2. 1 2 3 4 5 6 7 8 9 10 11 12 79 80 II 81 82 II 83 84 II 85 86 II 87 s t r e t c h i n g 88 II 89 90 II 91 d a n c e s p o r t s 92 II 93 ;4#; 94 II
녖였효과
 전문의약품 쎄레브렉스 캡슐 100 mg, 200 mg ( 세레콕시브 ) [ 원료약품의분량 ] 100 mg: 1캡슐 (270 mg) 중세레콕시브 (USP) 100 mg 첨가제 ( 타르색소 ): 청색 2호 200 mg: 1캡슐 (270 mg) 중세레콕시브 (USP) 200 mg [ 성상 ] 100 mg: 흰색내지회백색의분말이충진된푸른색줄이있는흰색의캡슐제 200
전문의약품 쎄레브렉스 캡슐 100 mg, 200 mg ( 세레콕시브 ) [ 원료약품의분량 ] 100 mg: 1캡슐 (270 mg) 중세레콕시브 (USP) 100 mg 첨가제 ( 타르색소 ): 청색 2호 200 mg: 1캡슐 (270 mg) 중세레콕시브 (USP) 200 mg [ 성상 ] 100 mg: 흰색내지회백색의분말이충진된푸른색줄이있는흰색의캡슐제 200
안 산 시 보 차 례 훈 령 안산시 훈령 제 485 호 [안산시 구 사무 전결처리 규정 일부개정 규정]------------------------------------------------- 2 안산시 훈령 제 486 호 [안산시 동 주민센터 전결사항 규정 일부개정 규
![안 산 시 보 차 례 훈 령 안산시 훈령 제 485 호 [안산시 구 사무 전결처리 규정 일부개정 규정]------------------------------------------------- 2 안산시 훈령 제 486 호 [안산시 동 주민센터 전결사항 규정 일부개정 규 안 산 시 보 차 례 훈 령 안산시 훈령 제 485 호 [안산시 구 사무 전결처리 규정 일부개정 규정]------------------------------------------------- 2 안산시 훈령 제 486 호 [안산시 동 주민센터 전결사항 규정 일부개정 규](/thumbs/40/22055693.jpg) 발행일 : 2013년 7월 25일 안 산 시 보 차 례 훈 령 안산시 훈령 제 485 호 [안산시 구 사무 전결처리 규정 일부개정 규정]------------------------------------------------- 2 안산시 훈령 제 486 호 [안산시 동 주민센터 전결사항 규정 일부개정 규정]--------------------------------------------
발행일 : 2013년 7월 25일 안 산 시 보 차 례 훈 령 안산시 훈령 제 485 호 [안산시 구 사무 전결처리 규정 일부개정 규정]------------------------------------------------- 2 안산시 훈령 제 486 호 [안산시 동 주민센터 전결사항 규정 일부개정 규정]--------------------------------------------
팜비어정 750mg ( 팜시클로비르 ) - 750mg Famvir tablet (famciclovir) 원료약품의분량 1 정중팜시클로비르 ( 별규 ) 750 mg 성상 흰색의타원형필름코팅정 효능 효과 대상포진바이러스감염증 용법 용량 1. 대상포진감염증의치료성인 : 팜시
 팜비어정 750mg ( 팜시클로비르 ) - 750mg Famvir tablet (famciclovir) 원료약품의분량 1 정중팜시클로비르 ( 별규 ) 750 mg 성상 흰색의타원형필름코팅정 효능 효과 대상포진바이러스감염증 용법 용량 1. 대상포진감염증의치료성인 : 팜시클로비르로서 1 일 1 회 750 mg 을 7 일간경구투여한다. 매일같은시간에복용한다. 감염후증상이나타나는즉시치료를시작하는것이바람직하다.
팜비어정 750mg ( 팜시클로비르 ) - 750mg Famvir tablet (famciclovir) 원료약품의분량 1 정중팜시클로비르 ( 별규 ) 750 mg 성상 흰색의타원형필름코팅정 효능 효과 대상포진바이러스감염증 용법 용량 1. 대상포진감염증의치료성인 : 팜시클로비르로서 1 일 1 회 750 mg 을 7 일간경구투여한다. 매일같은시간에복용한다. 감염후증상이나타나는즉시치료를시작하는것이바람직하다.
썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품및분량 ] 1정 (300mg) 중 유효성분 : 티아프로펜산 (EP)
![썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품및분량 ] 1정 (300mg) 중 유효성분 : 티아프로펜산 (EP) 썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품및분량 ] 1정 (300mg) 중 유효성분 : 티아프로펜산 (EP)](/thumbs/103/158619130.jpg) 썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품및분량 ] 1정 (300mg) 중 유효성분 : 티아프로펜산 (EP) ------------------------------------------ 200mg 기타첨가제 : 옥수수전분, 폴록사머, 스테아르산마그네슘, 탤크
썰감 R 정 200mg ( 티아프로펜산 ) Surgam tab. (Tiaprofenic acid) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품및분량 ] 1정 (300mg) 중 유효성분 : 티아프로펜산 (EP) ------------------------------------------ 200mg 기타첨가제 : 옥수수전분, 폴록사머, 스테아르산마그네슘, 탤크
뉴마스트세립 4 밀리그램 ( 몬테루카스트나트륨 ) mg 원료약품및분량 4.00 mg : 1 정중주성분몬테루카스트나트륨 ( 별규 ) 4.15 mg 성상 흰색또는거의황백색의세립 효능 효과 1. 천식의방지및지속적치료 2. 계절및연중알레르기비염증상완화 용법 용량
 뉴마스트세립 4 밀리그램 ( 몬테루카스트나트륨 ) - 4.00 mg 원료약품및분량 4.00 mg : 1 정중주성분몬테루카스트나트륨 ( 별규 ) 4.15 mg 성상 흰색또는거의황백색의세립 효능 효과 1. 천식의방지및지속적치료 2. 계절및연중알레르기비염증상완화 용법 용량 이약은 1 일 1 회복용하되, 천식환자의경우저녁에복용하고, 알레르기비염환자의경우는 환자의상태에따라투약시간을정한다.
뉴마스트세립 4 밀리그램 ( 몬테루카스트나트륨 ) - 4.00 mg 원료약품및분량 4.00 mg : 1 정중주성분몬테루카스트나트륨 ( 별규 ) 4.15 mg 성상 흰색또는거의황백색의세립 효능 효과 1. 천식의방지및지속적치료 2. 계절및연중알레르기비염증상완화 용법 용량 이약은 1 일 1 회복용하되, 천식환자의경우저녁에복용하고, 알레르기비염환자의경우는 환자의상태에따라투약시간을정한다.
 사용설명서 의료용 진동기 사용설명서는 언제나 볼 수 있는 장소에 보관하세요. 사용전 안전을 위한 주의사항 을 반드시 읽고 사용하세요. 사용설명서에 제품보증서가 포함되어 있습니다. 본 제품은 가정용 의료용 진동기이므로 상업용 또는 산업용 등으로는 사용을 금합니다. BM-1000HB www.lge.co.kr V V V V 3 4 V V C 5 6 주의 설 치
사용설명서 의료용 진동기 사용설명서는 언제나 볼 수 있는 장소에 보관하세요. 사용전 안전을 위한 주의사항 을 반드시 읽고 사용하세요. 사용설명서에 제품보증서가 포함되어 있습니다. 본 제품은 가정용 의료용 진동기이므로 상업용 또는 산업용 등으로는 사용을 금합니다. BM-1000HB www.lge.co.kr V V V V 3 4 V V C 5 6 주의 설 치
4. 톡소플라즈마 감염에 대한 혈액검사 그림 2. 톡소플라즈마증에 대한 혈액검사 톡소플라즈마에 대한 IgG 및 IgM 항체 검사를 통해 간단하게 과거 감염 또는 현재 감염 여부를 알 수 있으므로 혈액검사를 통해 현재 감염의 진단뿐 아니라 추후 예방 및 생활습관의 개선에
 애완동물과 관련된 기생충 감염 톡소플라즈마증과 톡소카라증 톡소플라즈마증(Toxoplasmosis). 톡소플라즈마증이란? 톡소플라즈마증은 톡소플라즈마 곤디(Toxoplasma gondii)라는 단세포 기생충에 의한 감염으로, 이 기생충은 일생의 대부분을 고양이 몸 속에서 보냅니다. 톡소플라즈마는 고양이와 쥐 등을 숙주로 삼는 기생충으로, 고양이의 소화기관에서만
애완동물과 관련된 기생충 감염 톡소플라즈마증과 톡소카라증 톡소플라즈마증(Toxoplasmosis). 톡소플라즈마증이란? 톡소플라즈마증은 톡소플라즈마 곤디(Toxoplasma gondii)라는 단세포 기생충에 의한 감염으로, 이 기생충은 일생의 대부분을 고양이 몸 속에서 보냅니다. 톡소플라즈마는 고양이와 쥐 등을 숙주로 삼는 기생충으로, 고양이의 소화기관에서만
?
 2018. SPRINGvol.137 SEOUL MEDICAL CENTER CONTENTS 06 10 20 14 18 20 06 10 14 30 26 30 32 HEALTHY LIVING 36 34 36 38 40 2018. SPRING vol.137 06 07 08 09 10 11 l a t e n t t u b e r c u l o s i s 12 13
2018. SPRINGvol.137 SEOUL MEDICAL CENTER CONTENTS 06 10 20 14 18 20 06 10 14 30 26 30 32 HEALTHY LIVING 36 34 36 38 40 2018. SPRING vol.137 06 07 08 09 10 11 l a t e n t t u b e r c u l o s i s 12 13
위장관계 위염 5 (1.1) 4 (0.9) 7 (0.7) 5 (0.5) 설사 5 (1.1) 2 (0.4) 14 (1.4) 10 (1.0) 복통 13 (2.8) 15 (3.2) 21 (2.1) 28 (2.9) 소화불량 12 (2.6) 18 (3.9) 40 (4.1) 26
 본비바주 ( 이반드론산나트륨일수화물 ) 전문의약품 원료약품및그분량 1 프리필드시린지 (3mL) 중주성분 : 이반드론산나트륨일수화물 ( 별규 )...3.375mg ( 이반드론산으로서 3mg) 등장화제 : 염화나트륨첨부물 : 1 회용주사침완충제 : 아세트산나트륨수화물용제 : 주사용증류수완충제 : 아세트산무수물 성상무색투명한용액이충전된프리필드시린지로서 1 회용주사침이첨부되어있다.
본비바주 ( 이반드론산나트륨일수화물 ) 전문의약품 원료약품및그분량 1 프리필드시린지 (3mL) 중주성분 : 이반드론산나트륨일수화물 ( 별규 )...3.375mg ( 이반드론산으로서 3mg) 등장화제 : 염화나트륨첨부물 : 1 회용주사침완충제 : 아세트산나트륨수화물용제 : 주사용증류수완충제 : 아세트산무수물 성상무색투명한용액이충전된프리필드시린지로서 1 회용주사침이첨부되어있다.
조스타박스주(대상포진생바이러스백신)
 알콕시아정 30 밀리그램 ( 에토리콕시브 ) 원료약품및분량 이약 1 정중 주성분 에토리콕시브----------------------------------------------------30밀리그램 ( 별규 ) 첨가제 ( 타르색소 ) 청색2호 ( 인디고카르민 ) 알루미늄레이크 성상 한면에는 101, 다른면에는 ACX30 이라고새겨진청녹색사과모양의양면이볼록한필름코팅정
알콕시아정 30 밀리그램 ( 에토리콕시브 ) 원료약품및분량 이약 1 정중 주성분 에토리콕시브----------------------------------------------------30밀리그램 ( 별규 ) 첨가제 ( 타르색소 ) 청색2호 ( 인디고카르민 ) 알루미늄레이크 성상 한면에는 101, 다른면에는 ACX30 이라고새겨진청녹색사과모양의양면이볼록한필름코팅정
튦
 NO. 2155 Since 1969 2016. 06. 15 www.catholicfound.org www.cmc.or.kr blog.naver.com/cmc_health twitter.com/cmcmedicalnews www.facebook.com/cmcmedicalnews 02 CATHOLIC MEDICAL TIMES Vol.2155 2016.06.15 03
NO. 2155 Since 1969 2016. 06. 15 www.catholicfound.org www.cmc.or.kr blog.naver.com/cmc_health twitter.com/cmcmedicalnews www.facebook.com/cmcmedicalnews 02 CATHOLIC MEDICAL TIMES Vol.2155 2016.06.15 03
파미온탈리도마이드캡슐 50mg
 레블리미드 캡슐 ( 레날리도마이드 ) 2.5 mg/5 mg/7.5 mg/10 mg/15 mg/20 mg/25 mg [ 분류번호 : 421] [ 전문의약품 ] [ 원료약품및그분량 ] 레블리미드 2.5밀리그램 1캡슐중, 레날리도마이드수화물 ( 별규 )----------------------------------2.59 mg ( 레날리도마이드무수물로서 2.5 mg)
레블리미드 캡슐 ( 레날리도마이드 ) 2.5 mg/5 mg/7.5 mg/10 mg/15 mg/20 mg/25 mg [ 분류번호 : 421] [ 전문의약품 ] [ 원료약품및그분량 ] 레블리미드 2.5밀리그램 1캡슐중, 레날리도마이드수화물 ( 별규 )----------------------------------2.59 mg ( 레날리도마이드무수물로서 2.5 mg)
Jkbcs016(92-97).hwp
 Expression of bcl-2 and Apoptosis and Its Relationship to Clinicopathological Prognostic Factors in Breast Cancer - A Study with Long Term Follow-up correlated with the survival rate.(journal of Korean
Expression of bcl-2 and Apoptosis and Its Relationship to Clinicopathological Prognostic Factors in Breast Cancer - A Study with Long Term Follow-up correlated with the survival rate.(journal of Korean
 - 3 - - 4 - - 5 - - 6 - - 7 - - 8 - 최종결과보고서요약문 - 9 - Summary - 10 - 학술연구용역과제연구결과 - 11 - - 12 - - 13 - - 14 - 질병관리본부의공고제 2012-241 호 (2012. 10. 15) 의제안요청서 (RFP) 에나타난주요 연구내용은다음과같다. 제안요청서 (RFP) 에서명시한내용을충실히이행하고구체적이고세세한전략방안을제시했다.
- 3 - - 4 - - 5 - - 6 - - 7 - - 8 - 최종결과보고서요약문 - 9 - Summary - 10 - 학술연구용역과제연구결과 - 11 - - 12 - - 13 - - 14 - 질병관리본부의공고제 2012-241 호 (2012. 10. 15) 의제안요청서 (RFP) 에나타난주요 연구내용은다음과같다. 제안요청서 (RFP) 에서명시한내용을충실히이행하고구체적이고세세한전략방안을제시했다.
<B4E3B9E8B0A1B0DD3033303830322DB9E8C6F7C0DAB7E12E687770>
 담배가격과 건강증진 - 1. 서론: 담배값 을 다시 보기 - 1 - 2. 고령사회( 高 齡 社 會 )와 고흡연율( 高 吸 煙 率 ): 위기의 복합 1) 과소평가되어 있는 담배 피해 - 2 - - 3 - 건 강 위 해 암, 만성호흡기계질환, 심혈관계질환의 지연 위험 등 급성호흡기계질환, 천식발작, 태아 영향, 심혈관계질환 조기 위험 등 흡연 시작 15-20년
담배가격과 건강증진 - 1. 서론: 담배값 을 다시 보기 - 1 - 2. 고령사회( 高 齡 社 會 )와 고흡연율( 高 吸 煙 率 ): 위기의 복합 1) 과소평가되어 있는 담배 피해 - 2 - - 3 - 건 강 위 해 암, 만성호흡기계질환, 심혈관계질환의 지연 위험 등 급성호흡기계질환, 천식발작, 태아 영향, 심혈관계질환 조기 위험 등 흡연 시작 15-20년
1 회 250 mg씩 1 일 1 회 250 mg씩 1 일 1 회 2) 급성재발성생식기포진감염증의치료 : 1 회 3) 재발성생식기포진감염증의억제 : 1 회 250 mg씩 1 일 4) 혈청크레아티닌만알고있을경우에는다음계산식으로크레아티닌청소율을구할수있다. 남자 : { 체중
 팜비어정 250mg ( 팜시클로비르 ) - 250mg Famvir tablet (famciclovir) 원료약품의분량 1 정중팜시클로비르 ( 별규 )... 250 mg 성상 흰색의원형필름코팅정 효능 효과 1. 대상포진바이러스감염증 2. 생식기포진감염증의치료및재발성생식기포진의억제 용법 1. 대상포진감염증의치료 성인 : 팜시클로비르로서 1 회 250 mg 씩 1
팜비어정 250mg ( 팜시클로비르 ) - 250mg Famvir tablet (famciclovir) 원료약품의분량 1 정중팜시클로비르 ( 별규 )... 250 mg 성상 흰색의원형필름코팅정 효능 효과 1. 대상포진바이러스감염증 2. 생식기포진감염증의치료및재발성생식기포진의억제 용법 1. 대상포진감염증의치료 성인 : 팜시클로비르로서 1 회 250 mg 씩 1
비다자(아자시티딘)주는 골수이형성증후군(MDS;Myelodysplastic syndrome) 치료에 세계 최초로 개발된 신약이며 미국 FDA에 2004년 5월 MDS 치료제로 최초 승인받은 약입니다
 비다자주 100 밀리그램 ( 아자시티딘 ) [ 전문의약품 ] [ 원료약품및그분량 ] 1바이알중아자시티딘 ( 별규 ) 100mg 만니톨 (EP) 100mg [ 성상 ] 흰색의동결건조분말또는덩어리를함유하는무색투명한바이알 [ 효능효과 ] 다음과같은환자의치료 ; 1. 골수형성이상증후군 (Myelodyplastic syndrome, MDS) 불응성빈혈 (RA), 환상철적모구가있는불응성빈혈
비다자주 100 밀리그램 ( 아자시티딘 ) [ 전문의약품 ] [ 원료약품및그분량 ] 1바이알중아자시티딘 ( 별규 ) 100mg 만니톨 (EP) 100mg [ 성상 ] 흰색의동결건조분말또는덩어리를함유하는무색투명한바이알 [ 효능효과 ] 다음과같은환자의치료 ; 1. 골수형성이상증후군 (Myelodyplastic syndrome, MDS) 불응성빈혈 (RA), 환상철적모구가있는불응성빈혈
 IL-1β, IL-1RN, IL-8, MUC, NAT, GST 등 ) IL-1β, IL-1RN, IL-8, MUC, NAT, GST 등 ) IL-1β, IL-1RN, IL-8, MUC, NAT, GST 등 ) l l l α β α β β α β β α β 목적 (Background/Aims): 위암의가족력과 Helicobacter pylori 감염은각각위암발생의위험인자로알려져있으나,
IL-1β, IL-1RN, IL-8, MUC, NAT, GST 등 ) IL-1β, IL-1RN, IL-8, MUC, NAT, GST 등 ) IL-1β, IL-1RN, IL-8, MUC, NAT, GST 등 ) l l l α β α β β α β β α β 목적 (Background/Aims): 위암의가족력과 Helicobacter pylori 감염은각각위암발생의위험인자로알려져있으나,
보험보상의 모든것
 보험보상의모든것 신체사정사 소개글 목차 1 중대한질병 / 중대한암 CI 중보험의약관상규정 4 2 갑상선암임파선전이 (C77) 소액암이아닌일반암청구하기!! 11 3 상해사고로인하여얼굴, 목, 머리의흉터, 함몰, 결손등으로인한추상장해 16 중대한질병 / 중대한암 CI 중보험의약관상규정 2015.04.29 13:44 이계약에서 중대한질병 이라함은 중대한질병의정의
보험보상의모든것 신체사정사 소개글 목차 1 중대한질병 / 중대한암 CI 중보험의약관상규정 4 2 갑상선암임파선전이 (C77) 소액암이아닌일반암청구하기!! 11 3 상해사고로인하여얼굴, 목, 머리의흉터, 함몰, 결손등으로인한추상장해 16 중대한질병 / 중대한암 CI 중보험의약관상규정 2015.04.29 13:44 이계약에서 중대한질병 이라함은 중대한질병의정의
로페라미드 (loperamide) 요약 로페라미드는지사제의일종이다. 장관의운동성을감소시켜장내수분및전해질이흡수되는시간을늘려다량의수분이대변으로빠져나가는설사증상을완화시킨다. 설사의원인을치료하는게아니고증상만감소시키므로설사가멈추면투여를중단해야한다. 외국어표기 loperamide
 요약 로페라미드는지사제의일종이다. 장관의운동성을감소시켜장내수분및전해질이흡수되는시간을늘려다량의수분이대변으로빠져나가는설사증상을완화시킨다. 설사의원인을치료하는게아니고증상만감소시키므로설사가멈추면투여를중단해야한다. 외국어표기 loperamide( 영어 ) CAS 등록번호 53179-11-6 ATC 코드 A07DA03 분자식 C 29 H 33 N 2 O 2 분자량 477.045
요약 로페라미드는지사제의일종이다. 장관의운동성을감소시켜장내수분및전해질이흡수되는시간을늘려다량의수분이대변으로빠져나가는설사증상을완화시킨다. 설사의원인을치료하는게아니고증상만감소시키므로설사가멈추면투여를중단해야한다. 외국어표기 loperamide( 영어 ) CAS 등록번호 53179-11-6 ATC 코드 A07DA03 분자식 C 29 H 33 N 2 O 2 분자량 477.045
전문의약품 의약품분류번호 149 싱귤레어정 10 밀리그램 싱귤레어츄정 5 밀리그램 싱귤레어츄정 4 밀리그램 싱귤레어세립 4 밀리그램 ( 몬테루카스트나트륨 ) 원료약품및분량 < 싱귤레어정10밀리그램 > 1 정 (205.0 mg) 중 주성분 몬테루카스트나트륨 (EP) --
 전문의약품 의약품분류번호 149 싱귤레어정 10 밀리그램 싱귤레어츄정 5 밀리그램 싱귤레어츄정 4 밀리그램 싱귤레어세립 4 밀리그램 ( 몬테루카스트나트륨 ) 원료약품및분량 < 싱귤레어정10밀리그램 > 1 정 (205.0 mg) 중 주성분 몬테루카스트나트륨 (EP) -----------------------------------------10.4 mg ( 몬테루카스트로서
전문의약품 의약품분류번호 149 싱귤레어정 10 밀리그램 싱귤레어츄정 5 밀리그램 싱귤레어츄정 4 밀리그램 싱귤레어세립 4 밀리그램 ( 몬테루카스트나트륨 ) 원료약품및분량 < 싱귤레어정10밀리그램 > 1 정 (205.0 mg) 중 주성분 몬테루카스트나트륨 (EP) -----------------------------------------10.4 mg ( 몬테루카스트로서
렌벨라 R 정 ( 세벨라머탄산염 ) Renvela tab. (Sevelamer carbonate) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1 정 (999.9mg) 중 세벨라머탄산염 ( 별규 ) 800.0mg [ 성상 ] RENVELA 800이인쇄되
![렌벨라 R 정 ( 세벨라머탄산염 ) Renvela tab. (Sevelamer carbonate) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1 정 (999.9mg) 중 세벨라머탄산염 ( 별규 ) 800.0mg [ 성상 ] RENVELA 800이인쇄되 렌벨라 R 정 ( 세벨라머탄산염 ) Renvela tab. (Sevelamer carbonate) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1 정 (999.9mg) 중 세벨라머탄산염 ( 별규 ) 800.0mg [ 성상 ] RENVELA 800이인쇄되](/thumbs/94/118949298.jpg) 렌벨라 R 정 ( 세벨라머탄산염 ) Renvela tab. (Sevelamer carbonate) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1 정 (999.9mg) 중 세벨라머탄산염 ( 별규 ) 800.0mg [ 성상 ] RENVELA 800이인쇄되어있는백색-회백색의타원형필름코팅정 [ 효능효과 ] 투석을받고있는만성신장질환환자의혈청인조절 [
렌벨라 R 정 ( 세벨라머탄산염 ) Renvela tab. (Sevelamer carbonate) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1 정 (999.9mg) 중 세벨라머탄산염 ( 별규 ) 800.0mg [ 성상 ] RENVELA 800이인쇄되어있는백색-회백색의타원형필름코팅정 [ 효능효과 ] 투석을받고있는만성신장질환환자의혈청인조절 [
조스타박스주(대상포진생바이러스백신)
 전문의약품 의약품분류번호 149 싱귤레어정 10 밀리그램 싱귤레어츄정 5 밀리그램 싱귤레어츄정 4 밀리그램 ( 몬테루카스트나트륨 ) 원료약품및분량 < 싱귤레어정10밀리그램 > 1 정 (205.0 mg) 중 주성분 몬테루카스트나트륨 (EP) -----------------------------------------10.4 mg ( 몬테루카스트로서 10.0 mg)
전문의약품 의약품분류번호 149 싱귤레어정 10 밀리그램 싱귤레어츄정 5 밀리그램 싱귤레어츄정 4 밀리그램 ( 몬테루카스트나트륨 ) 원료약품및분량 < 싱귤레어정10밀리그램 > 1 정 (205.0 mg) 중 주성분 몬테루카스트나트륨 (EP) -----------------------------------------10.4 mg ( 몬테루카스트로서 10.0 mg)
(01) hwp
 Journal of Life Science 2013 Vol. 23. No. 2. 157~166 ISSN (Print) 1225-9918 ISSN (Online) 2287-3406 DOI : http://dx.doi.org/10.5352/jls.2013.23.2.157 α μ δ κ 158 생명과학회지 2013, Vol. 23. No. 2 Journal of
Journal of Life Science 2013 Vol. 23. No. 2. 157~166 ISSN (Print) 1225-9918 ISSN (Online) 2287-3406 DOI : http://dx.doi.org/10.5352/jls.2013.23.2.157 α μ δ κ 158 생명과학회지 2013, Vol. 23. No. 2 Journal of
FGUYPYUYJJHU.hwp
 차아황산 나트륨 () CASNO:7775-14-6 OECD SIDS 위해성평가 결과 요약서 CAS No. 7775-14-6 화학물질명 차아황산나트륨() 구조식 인체건강영향 차아황산나트륨 () 은 생리적 상태에서 불안정하고, 산성이 증가함에 따라 분 - 2- 해율도 증가한다. 습기가 있을 경우 아황산 수소(HSO 3 ), 아황산염 (SO 3 ) 및 황화수소 (HSO
차아황산 나트륨 () CASNO:7775-14-6 OECD SIDS 위해성평가 결과 요약서 CAS No. 7775-14-6 화학물질명 차아황산나트륨() 구조식 인체건강영향 차아황산나트륨 () 은 생리적 상태에서 불안정하고, 산성이 증가함에 따라 분 - 2- 해율도 증가한다. 습기가 있을 경우 아황산 수소(HSO 3 ), 아황산염 (SO 3 ) 및 황화수소 (HSO
전문의약품 의약품분류번호 399 포사맥스 70 밀리그램정 ( 알렌드론산나트륨 ) 원료약품및분량 1 정 ( 약 mg) 중 주성분 : 알렌드론산나트륨 ( 별규 ) ( 알렌드론산으로서 mg)
 포사맥스 70 밀리그램정 ( 알렌드론산나트륨 ) 원료약품및분량 1 정 ( 약 350.0 mg) 중 주성분 : 알렌드론산나트륨 ( 별규 ) ( 알렌드론산으로서 70.00 mg) ---------------------------------------- 91.37 mg 성상 백색의타원형정제로서한면에는뼈그림, 다른면에는 "31" 이새겨져있다. 효능 효과 1. 폐경후여성의골다공증치료
포사맥스 70 밀리그램정 ( 알렌드론산나트륨 ) 원료약품및분량 1 정 ( 약 350.0 mg) 중 주성분 : 알렌드론산나트륨 ( 별규 ) ( 알렌드론산으로서 70.00 mg) ---------------------------------------- 91.37 mg 성상 백색의타원형정제로서한면에는뼈그림, 다른면에는 "31" 이새겨져있다. 효능 효과 1. 폐경후여성의골다공증치료
2/7 2/6 서론 급성기관지염 (Acute Bronchitis) 저자최선 가톨릭중앙의료원연구윤리사무국피험자보호팀장 약학정보원학술자문위원 고염증이 ~~ 개요 기관지염은지속기간에따라대략 10일미만인급성과수주간지속되는만성으로나눌수있다. 이중감기나독감과유사한증상을보이는급성기
 2/7 2/6 서론 저자최선 가톨릭중앙의료원연구윤리사무국피험자보호팀장 약학정보원학술자문위원 고염증이 ~~ 개요 기관지염은지속기간에따라대략 10일미만인급성과수주간지속되는만성으로나눌수있다. 이중감기나독감과유사한증상을보이는급성기관지염의주요특성과예방및치료방법에대해정리해보고자한다. 유전성, 후 키워드 급성기관지염, 급성기관지염의치료 개요 기관지염 ( 氣管支炎, bronchitis)
2/7 2/6 서론 저자최선 가톨릭중앙의료원연구윤리사무국피험자보호팀장 약학정보원학술자문위원 고염증이 ~~ 개요 기관지염은지속기간에따라대략 10일미만인급성과수주간지속되는만성으로나눌수있다. 이중감기나독감과유사한증상을보이는급성기관지염의주요특성과예방및치료방법에대해정리해보고자한다. 유전성, 후 키워드 급성기관지염, 급성기관지염의치료 개요 기관지염 ( 氣管支炎, bronchitis)
 제 62 호의약품안전성정보 Drug Safety Information CONTENTS Ⅰ. 허가사항변경지시현황 1. 의약품재심사결과현황 3 2. 안전성정보처리현황 73 Ⅱ. 안전성서한 ( 속보 ) 배포현황 1. 의약품안전성서한발행현황 333 Ⅲ. 참고자료 1. 의약품등의안전에관한규칙 359 2. 신약등의재심사기준 377 Ⅳ. 찾아보기 1. 한글성분명 397
제 62 호의약품안전성정보 Drug Safety Information CONTENTS Ⅰ. 허가사항변경지시현황 1. 의약품재심사결과현황 3 2. 안전성정보처리현황 73 Ⅱ. 안전성서한 ( 속보 ) 배포현황 1. 의약품안전성서한발행현황 333 Ⅲ. 참고자료 1. 의약품등의안전에관한규칙 359 2. 신약등의재심사기준 377 Ⅳ. 찾아보기 1. 한글성분명 397
Journal of Life Science 2011, Vol. 21. No μ μ
 Journal of Life Science 2011 Vol. 21. No. 8. 1120~1126 ISSN : 1225-9918 DOI : http://dx.doi.org/10.5352/jls.2011.21.8.1120 μ μ μ α β Journal of Life Science 2011, Vol. 21. No. 8 1121 μ μ 1122 생명과학회지 2011,
Journal of Life Science 2011 Vol. 21. No. 8. 1120~1126 ISSN : 1225-9918 DOI : http://dx.doi.org/10.5352/jls.2011.21.8.1120 μ μ μ α β Journal of Life Science 2011, Vol. 21. No. 8 1121 μ μ 1122 생명과학회지 2011,
비가목스점안액 0.5% ( 목시플록사신염산염 ) 5mL Vigamox Eye Drops 0.5% 원료약품및그분량 1 ml 중주성분 : 목시플록사신염산염 ( 별규 ) mg ( 목시플록사신으로서 5mg) 첨가제 : 염화나트륨, 붕산, 염산, 수산화나트륨, 정제
 비가목스점안액 0.5% ( 목시플록사신염산염 ) 5mL Vigamox Eye Drops 0.5% 원료약품및그분량 1 ml 중주성분 : 목시플록사신염산염 ( 별규 )... 5.45mg ( 목시플록사신으로서 5mg) 첨가제 : 염화나트륨, 붕산, 염산, 수산화나트륨, 정제수 성상 반투명한플라스틱용기에든엷은녹황색의점안액 효능 효과다음의감수성균종에의한세균성결막염,
비가목스점안액 0.5% ( 목시플록사신염산염 ) 5mL Vigamox Eye Drops 0.5% 원료약품및그분량 1 ml 중주성분 : 목시플록사신염산염 ( 별규 )... 5.45mg ( 목시플록사신으로서 5mg) 첨가제 : 염화나트륨, 붕산, 염산, 수산화나트륨, 정제수 성상 반투명한플라스틱용기에든엷은녹황색의점안액 효능 효과다음의감수성균종에의한세균성결막염,
병원이왜내지최종본1
 아토피 건선 습진 무좀 탈모 등 피부병은 물론 비만 당뇨 변비 고혈압 생리통 관절염 류머티즘 설사 등 속병도 스스로 간단히 치료하는 비법 100평 아파트도 건강을 잃으면 월세방만 못하다. 자녀를 사랑하면 이책을 반드시 읽게 하라 지은사람 99세까지 88하게 살기운동본부 펴낸곳 청 인 저자 회춘 모습 병원검진 생체나이 40대 초반 Contents 4 5 6
아토피 건선 습진 무좀 탈모 등 피부병은 물론 비만 당뇨 변비 고혈압 생리통 관절염 류머티즘 설사 등 속병도 스스로 간단히 치료하는 비법 100평 아파트도 건강을 잃으면 월세방만 못하다. 자녀를 사랑하면 이책을 반드시 읽게 하라 지은사람 99세까지 88하게 살기운동본부 펴낸곳 청 인 저자 회춘 모습 병원검진 생체나이 40대 초반 Contents 4 5 6
<BAD9C0D3335FBFACB1B8BAB8B0EDBCAD5FC0CCC1D8C8AB5FBCF6C1A4BFCFB7E E687770>
 연구보고서 2016-20-006 www.nhimc.or.kr 한국인치매환자의암발생에관한연구 이준홍 이지은 김동욱 2016 NHIS Ilsan Hospital National Health Insurance Service Ilsan Hospital 연구보고서 2016-20-006 한국인치매환자의암발생에관한연구 이준홍 이지은 김동욱 본연구보고서에실린내용은국민건강보험일산병원의공식적인견해와다를수있음을밝혀둡니다.
연구보고서 2016-20-006 www.nhimc.or.kr 한국인치매환자의암발생에관한연구 이준홍 이지은 김동욱 2016 NHIS Ilsan Hospital National Health Insurance Service Ilsan Hospital 연구보고서 2016-20-006 한국인치매환자의암발생에관한연구 이준홍 이지은 김동욱 본연구보고서에실린내용은국민건강보험일산병원의공식적인견해와다를수있음을밝혀둡니다.
2. 원인 뼈에 가해진 외력을 견디지 못할 때 뼈는 부러지게 됩니다. 이러한 외력으로는 낙상, 자동차 사고, 추락 등이 있으며, 외 력의 양상에 따라 골절의 형태가 달라지게 됩니다. 3. 증상 뼈가 부러지면 극심한 통증이 동반되는데 주요 증상은 다음 과 같습니다. 1)
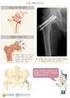 종합 병원 서 울 성 심 병 원 본 자료는 대한정형외과학회 학회지에 기재된 자료를 환자분들이 편하게 이용하실 수 있도록 재구성한 것입니다. 골 절 1. 개요 우리 몸에는 크고 작은 뼈가 200 여 개 있는데, 근육과 힘줄 로 서로 단단히 연결되어 뼈대를 이루고 있습니다. 뼈는 몸 속의 중요한 장기들을 보호하고, 혈액을 생성하며, 이동을 가 능하게 하는 중요한
종합 병원 서 울 성 심 병 원 본 자료는 대한정형외과학회 학회지에 기재된 자료를 환자분들이 편하게 이용하실 수 있도록 재구성한 것입니다. 골 절 1. 개요 우리 몸에는 크고 작은 뼈가 200 여 개 있는데, 근육과 힘줄 로 서로 단단히 연결되어 뼈대를 이루고 있습니다. 뼈는 몸 속의 중요한 장기들을 보호하고, 혈액을 생성하며, 이동을 가 능하게 하는 중요한
( )Kju269.hwp
 만성세균성전립선염모델흰쥐에서 의항염효과 Anti-inflammatory Effect of Lycopene on Chronic Bacterial Prostatitis Rat Model Cho Hwan Yang, Dong Wan Sohn, Yong-Hyun Cho From the Department of Urology, The Catholic University
만성세균성전립선염모델흰쥐에서 의항염효과 Anti-inflammatory Effect of Lycopene on Chronic Bacterial Prostatitis Rat Model Cho Hwan Yang, Dong Wan Sohn, Yong-Hyun Cho From the Department of Urology, The Catholic University
제품설명서Template
 전문의약품 비비안트정 20 밀리그람 ( 바제독시펜아세테이트 ) Viviant Tablet 20mg (Bazedoxifene Acetate) [ 원료약품의분량 ] - 1 정 ( 약 414 mg) 중 - 바제독시펜아세테이트 ( 별규 ) ( 바제독시펜으로서 20.0 mg) 22.6 mg [ 성상 ] 흰색 ~ 회백색의캡슐모양의필름코팅정 [ 효능 효과 ] 폐경후여성의골다공증치료및예방단,
전문의약품 비비안트정 20 밀리그람 ( 바제독시펜아세테이트 ) Viviant Tablet 20mg (Bazedoxifene Acetate) [ 원료약품의분량 ] - 1 정 ( 약 414 mg) 중 - 바제독시펜아세테이트 ( 별규 ) ( 바제독시펜으로서 20.0 mg) 22.6 mg [ 성상 ] 흰색 ~ 회백색의캡슐모양의필름코팅정 [ 효능 효과 ] 폐경후여성의골다공증치료및예방단,
<30322EBFC0BCF6BFB52E687770>
 성염색체 이상의 산전 상담 성균관대학교 의과대학 삼성서울병원 산부인과 오 수 영 Soo-Young Oh, M.D., Ph.D. Department of Obstetrics and Gynecology, Samsung Medical Center, Sungkyunkwan University School of Medicine, Seoul, Korea 1서 성염색체이상은
성염색체 이상의 산전 상담 성균관대학교 의과대학 삼성서울병원 산부인과 오 수 영 Soo-Young Oh, M.D., Ph.D. Department of Obstetrics and Gynecology, Samsung Medical Center, Sungkyunkwan University School of Medicine, Seoul, Korea 1서 성염색체이상은
Sildenafil Tablets
 전문의약품, 오 남용우려의약품 비아그라 정 50 mg, 100 mg ( 실데나필시트르산염 ) [ 원료약품의분량 ] 50mg: 1 정 (309.750 mg) 중 실데나필시트르산염 ( 실데나필로서 50 mg) ( 별규 )...70.225 mg 100mg: 1 정 (619.500 mg) 중 실데나필시트르산염 ( 실데나필로서 100 mg) ( 별규 )...140.450
전문의약품, 오 남용우려의약품 비아그라 정 50 mg, 100 mg ( 실데나필시트르산염 ) [ 원료약품의분량 ] 50mg: 1 정 (309.750 mg) 중 실데나필시트르산염 ( 실데나필로서 50 mg) ( 별규 )...70.225 mg 100mg: 1 정 (619.500 mg) 중 실데나필시트르산염 ( 실데나필로서 100 mg) ( 별규 )...140.450
- I -
 직업성조혈기계암감시체계 구축 운용 전남대학교병원 채홍재 - I - - II - 요약문 1. 과제명 : 2. 사업기간 : 3. 연구자 : 전남대학교병원채홍재 4. 사업목적및필요성 5. 사업방법및내용 - III - 6. 사업결과 7. 활용계획 8. 중심어 - IV - 차례 - V - - VI - 표차례 - VII - - VIII - 그림차례 - IX - I. 서론
직업성조혈기계암감시체계 구축 운용 전남대학교병원 채홍재 - I - - II - 요약문 1. 과제명 : 2. 사업기간 : 3. 연구자 : 전남대학교병원채홍재 4. 사업목적및필요성 5. 사업방법및내용 - III - 6. 사업결과 7. 활용계획 8. 중심어 - IV - 차례 - V - - VI - 표차례 - VII - - VIII - 그림차례 - IX - I. 서론
<B1DDC0B6B1E2B0FCB0FAC0CEC5CDB3DDB0B3C0CEC1A4BAB82E687770>
 여 48.6% 남 51.4% 40대 10.7% 50대 이 상 6.0% 10대 0.9% 20대 34.5% 30대 47.9% 초등졸 이하 대학원생 이 0.6% 중졸 이하 상 0.7% 2.7% 고졸 이하 34.2% 대졸 이하 61.9% 직장 1.9% e-mail 주소 2.8% 핸드폰 번호 8.2% 전화번호 4.5% 학교 0.9% 주소 2.0% 기타 0.4% 이름
여 48.6% 남 51.4% 40대 10.7% 50대 이 상 6.0% 10대 0.9% 20대 34.5% 30대 47.9% 초등졸 이하 대학원생 이 0.6% 중졸 이하 상 0.7% 2.7% 고졸 이하 34.2% 대졸 이하 61.9% 직장 1.9% e-mail 주소 2.8% 핸드폰 번호 8.2% 전화번호 4.5% 학교 0.9% 주소 2.0% 기타 0.4% 이름
Taxotere 1-vial inj. (Docetaxel Trihydrate)
 탁소텔 R 1- 바이알주 ( 도세탁셀수화물 ) Taxotere 1-vial inj. (Docetaxel Trihydrate) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1mL 중주성분 : 도세탁셀수화물 ( 별규 ) 21.34mg ( 도세탁셀무수물로서 20.0mg) 첨가제 : 폴리소르베이트80 ( 별규 ), 무수에탄올 (EP) [ 성상 ] 무색투명한바이알에든황색
탁소텔 R 1- 바이알주 ( 도세탁셀수화물 ) Taxotere 1-vial inj. (Docetaxel Trihydrate) 전문의약품 사노피 - 아벤티스코리아 [ 원료약품분량 ] 이약 1mL 중주성분 : 도세탁셀수화물 ( 별규 ) 21.34mg ( 도세탁셀무수물로서 20.0mg) 첨가제 : 폴리소르베이트80 ( 별규 ), 무수에탄올 (EP) [ 성상 ] 무색투명한바이알에든황색
전문의약품 의약품분류번호 132 나조넥스나잘스프레이 ( 모메타손푸로에이트 ) 원료약품및분량 이약 1mL 중주성분 : 모메타손푸로에이트 ( 별규 ) mg ( 모메타손푸로에이트로서0.5
 나조넥스나잘스프레이 ( 모메타손푸로에이트 ) 원료약품및분량 이약 1mL 중주성분 : 모메타손푸로에이트 ( 별규 ) --------------------------------------------0.517mg ( 모메타손푸로에이트로서0.5mg) 첨가제 ( 보존제 ): 벤잘코늄염화물 -----------------------------------------------0.2mg
나조넥스나잘스프레이 ( 모메타손푸로에이트 ) 원료약품및분량 이약 1mL 중주성분 : 모메타손푸로에이트 ( 별규 ) --------------------------------------------0.517mg ( 모메타손푸로에이트로서0.5mg) 첨가제 ( 보존제 ): 벤잘코늄염화물 -----------------------------------------------0.2mg
2017 암검진표_1220
 2018년 암 검진 안내 최근 10년간 본인의 검진결과 확인 건강정보전문 포털사이트 (http://hi.nhis.or.kr/건강검진) 국민건강보험 모바일 앱 (M건강보험/검진결과 조회) 건강검진 주의사항 빠르고 정확한 검진을 위하여 반드시 주의사항을 확인하시고 검진 받으시기 바랍니다. 01. 예약 후 방문 검진기관 사정(예약 집중 등)에 따라 예약이 조기에
2018년 암 검진 안내 최근 10년간 본인의 검진결과 확인 건강정보전문 포털사이트 (http://hi.nhis.or.kr/건강검진) 국민건강보험 모바일 앱 (M건강보험/검진결과 조회) 건강검진 주의사항 빠르고 정확한 검진을 위하여 반드시 주의사항을 확인하시고 검진 받으시기 바랍니다. 01. 예약 후 방문 검진기관 사정(예약 집중 등)에 따라 예약이 조기에
기관고유연구사업결과보고
 기관고유연구사업결과보고 μ μ 해당년도 2008년 2009년 2010년 의뢰부서 과제의뢰의뢰총 Sample reaction 수책임자건수 sample수 (Assay * sample수 ) 암코호트과 성ㅇㅇ 1 936 31,824 기능유전체연구과 이ㅇㅇ 1 948 11,376 유방암연구과 이ㅇㅇ 1 344 344 폐암연구과
기관고유연구사업결과보고 μ μ 해당년도 2008년 2009년 2010년 의뢰부서 과제의뢰의뢰총 Sample reaction 수책임자건수 sample수 (Assay * sample수 ) 암코호트과 성ㅇㅇ 1 936 31,824 기능유전체연구과 이ㅇㅇ 1 948 11,376 유방암연구과 이ㅇㅇ 1 344 344 폐암연구과
머리말 대한결핵 및 호흡기학회 문 화 식 결핵은 고대로부터 인류에게 큰 고통을 주고 있는 전염병으로, 우리나라의 경우 과거에 비해 결핵환자가 많이 감소하였으나 여전히 높은 발생률과 사망률을 보이는 매우 심각한 전염병입니다. 결핵을 퇴치하기 위해서는 환자를 조기에 발견하
 Ver.03 결핵은 무슨 병인가요? 환자와 보호자가 궁금해하는 60가지 대한결핵 및 호흡기학회 머리말 대한결핵 및 호흡기학회 문 화 식 결핵은 고대로부터 인류에게 큰 고통을 주고 있는 전염병으로, 우리나라의 경우 과거에 비해 결핵환자가 많이 감소하였으나 여전히 높은 발생률과 사망률을 보이는 매우 심각한 전염병입니다. 결핵을 퇴치하기 위해서는 환자를 조기에 발견하고,
Ver.03 결핵은 무슨 병인가요? 환자와 보호자가 궁금해하는 60가지 대한결핵 및 호흡기학회 머리말 대한결핵 및 호흡기학회 문 화 식 결핵은 고대로부터 인류에게 큰 고통을 주고 있는 전염병으로, 우리나라의 경우 과거에 비해 결핵환자가 많이 감소하였으나 여전히 높은 발생률과 사망률을 보이는 매우 심각한 전염병입니다. 결핵을 퇴치하기 위해서는 환자를 조기에 발견하고,
보도자료(14-0325).hwp
 http://kostat.go.kr 보도자료 배포시부터 사용하시기 바랍니다. 배포일시 214. 3. 25.(화) 9:3 담당부서 담 당 자 통계정책국 통계기준과 과 장: 최종록(42-481-26) 사무관: 이춘우(42-481-2574) 질병분류 궁금증, 통계청에서 해결했어요.!! - 질병분류상담센터 개설 6개월 운영결과 분석 - 통계청(청장 박형수)은 지난해
http://kostat.go.kr 보도자료 배포시부터 사용하시기 바랍니다. 배포일시 214. 3. 25.(화) 9:3 담당부서 담 당 자 통계정책국 통계기준과 과 장: 최종록(42-481-26) 사무관: 이춘우(42-481-2574) 질병분류 궁금증, 통계청에서 해결했어요.!! - 질병분류상담센터 개설 6개월 운영결과 분석 - 통계청(청장 박형수)은 지난해
전문의약품 421: 항악성종양제 블린사이토 주 35 μg/ 바이알 ( 블리나투모맙, 유전자재조합 ) [ 조성 ] [ 완제의약품 ] 1 바이알중주성분 : 블리나투모맙 ( 별규 ) 38.5 μg 첨가제 : 시트르산수화물, L-리신염산염 ( 안정제, mg), 폴리
![전문의약품 421: 항악성종양제 블린사이토 주 35 μg/ 바이알 ( 블리나투모맙, 유전자재조합 ) [ 조성 ] [ 완제의약품 ] 1 바이알중주성분 : 블리나투모맙 ( 별규 ) 38.5 μg 첨가제 : 시트르산수화물, L-리신염산염 ( 안정제, mg), 폴리 전문의약품 421: 항악성종양제 블린사이토 주 35 μg/ 바이알 ( 블리나투모맙, 유전자재조합 ) [ 조성 ] [ 완제의약품 ] 1 바이알중주성분 : 블리나투모맙 ( 별규 ) 38.5 μg 첨가제 : 시트르산수화물, L-리신염산염 ( 안정제, mg), 폴리](/thumbs/103/157337704.jpg) 전문의약품 421: 항악성종양제 블린사이토 주 35 μg/ 바이알 ( 블리나투모맙, 유전자재조합 ) [ 조성 ] [ 완제의약품 ] 1 바이알중주성분 : 블리나투모맙 ( 별규 ) 38.5 μg 첨가제 : 시트르산수화물, L-리신염산염 ( 안정제, 25.55 mg), 폴리소르베이트 80, 알파, 알파-트레할로스이수화물 ( 안정제, 105.0 mg), 수산화나트륨
전문의약품 421: 항악성종양제 블린사이토 주 35 μg/ 바이알 ( 블리나투모맙, 유전자재조합 ) [ 조성 ] [ 완제의약품 ] 1 바이알중주성분 : 블리나투모맙 ( 별규 ) 38.5 μg 첨가제 : 시트르산수화물, L-리신염산염 ( 안정제, 25.55 mg), 폴리소르베이트 80, 알파, 알파-트레할로스이수화물 ( 안정제, 105.0 mg), 수산화나트륨
식품의약품안전처 수신자 ( 경유 ) 세엘진 ( 유 ), 대표 : 앤드류데이비드헥스터귀하 ( 우 서울특 별시강남구테헤란로 87 길 36, 1505 호 ( 삼성동, 도심공항타워 ) [ 영업소 ]) 제목재심사결과통지서발급및허가사항변경지시알림 [ 세엘진 ( 유 ),
![식품의약품안전처 수신자 ( 경유 ) 세엘진 ( 유 ), 대표 : 앤드류데이비드헥스터귀하 ( 우 서울특 별시강남구테헤란로 87 길 36, 1505 호 ( 삼성동, 도심공항타워 ) [ 영업소 ]) 제목재심사결과통지서발급및허가사항변경지시알림 [ 세엘진 ( 유 ), 식품의약품안전처 수신자 ( 경유 ) 세엘진 ( 유 ), 대표 : 앤드류데이비드헥스터귀하 ( 우 서울특 별시강남구테헤란로 87 길 36, 1505 호 ( 삼성동, 도심공항타워 ) [ 영업소 ]) 제목재심사결과통지서발급및허가사항변경지시알림 [ 세엘진 ( 유 ),](/thumbs/91/105133033.jpg) 허가사항변경지시 ( 재심사 ) 에따른공고 _ 레블리 미드캡슐 항상저희세엘진을아껴주시는여러선생님들께감사드립니다. 식품의약품안전처에서는공문 의약품안전평가과-926 (2017.11.07) 에의해아래제품의사용상의주의사항을변경토록지시하였습니다. 이에따라해당제품의제품설명서가 2017 년 12 월 07 일자로변경되었음을알려드리고자합니다. 해당제품 : 레블리미드캡슐 2.5,
허가사항변경지시 ( 재심사 ) 에따른공고 _ 레블리 미드캡슐 항상저희세엘진을아껴주시는여러선생님들께감사드립니다. 식품의약품안전처에서는공문 의약품안전평가과-926 (2017.11.07) 에의해아래제품의사용상의주의사항을변경토록지시하였습니다. 이에따라해당제품의제품설명서가 2017 년 12 월 07 일자로변경되었음을알려드리고자합니다. 해당제품 : 레블리미드캡슐 2.5,
untitled
 자누비아정 100 밀리그램 자누비아정 50 밀리그램 자누비아정 25 밀리그램 원료약품및분량 자누비아정100밀리그램 : 1정 (416.1 mg) 중, 주성분 : 시타글립틴인산염수화물 ( 별규 ) 128.5 mg ( 시타글립틴으로서 100 mg) 자누비아정 50밀리그램 : 1정 (208.0 mg) 중, 주성분 : 시타글립틴인산염수화물 ( 별규 ) 64.25 mg
자누비아정 100 밀리그램 자누비아정 50 밀리그램 자누비아정 25 밀리그램 원료약품및분량 자누비아정100밀리그램 : 1정 (416.1 mg) 중, 주성분 : 시타글립틴인산염수화물 ( 별규 ) 128.5 mg ( 시타글립틴으로서 100 mg) 자누비아정 50밀리그램 : 1정 (208.0 mg) 중, 주성분 : 시타글립틴인산염수화물 ( 별규 ) 64.25 mg
제브타나Ⓡ주 (카바지탁셀아세톤용매화물) - Jevtana inj. (Cabazitaxel)
 제브타나 R 주 ( 카바지탁셀아세톤용매화물 ) Jevtana inj. (Cabazitaxel) 전문의약품희귀사노피-아벤티스코리아 [ 원료약품분량 ] 본액 1 ml 중 ( 주성분 ) 카바지탁셀아세톤용매화물 ( 별규 ) 42.8 mg ( 카바지탁셀로서 40.0 mg) 용매 1 ml 중 ( 용매 ) 알코올 127.4 mg ( 용매 ) 주사용수 적량 [ 성상 ] 황색
제브타나 R 주 ( 카바지탁셀아세톤용매화물 ) Jevtana inj. (Cabazitaxel) 전문의약품희귀사노피-아벤티스코리아 [ 원료약품분량 ] 본액 1 ml 중 ( 주성분 ) 카바지탁셀아세톤용매화물 ( 별규 ) 42.8 mg ( 카바지탁셀로서 40.0 mg) 용매 1 ml 중 ( 용매 ) 알코올 127.4 mg ( 용매 ) 주사용수 적량 [ 성상 ] 황색
천식환자교육자료_0509
 천식 주제목록 1. 알레르기 질환이란? 2.천식이란? 천식에 대해 알아볼까요!! 3.천식을 악화시키는 것은? -- 원인과 악화 요인 4. 천식의 자가진단 5. 천식의 종류 - 나도 천식인가요? 6. 천식은 어떻게 진단하나요? 7. 천식도 치료기준이 있나요? 8. 천식환자가 응급실에 가야 할 때 9. 천식이 악화되면 어떻게 해야 하나요? --- 천식의 급성 악화
천식 주제목록 1. 알레르기 질환이란? 2.천식이란? 천식에 대해 알아볼까요!! 3.천식을 악화시키는 것은? -- 원인과 악화 요인 4. 천식의 자가진단 5. 천식의 종류 - 나도 천식인가요? 6. 천식은 어떻게 진단하나요? 7. 천식도 치료기준이 있나요? 8. 천식환자가 응급실에 가야 할 때 9. 천식이 악화되면 어떻게 해야 하나요? --- 천식의 급성 악화
Kaes025.hwp
 고위험군유두상갑상선암환자에대한방사성옥소최대허용선량측정법및치료법의검증 Verification of Measurement Methods and Therapeutic Efficacy of Maximum Permissible Dose of I-131 in High Risk Patients with Differentiated Papillary Thyroid Cancer
고위험군유두상갑상선암환자에대한방사성옥소최대허용선량측정법및치료법의검증 Verification of Measurement Methods and Therapeutic Efficacy of Maximum Permissible Dose of I-131 in High Risk Patients with Differentiated Papillary Thyroid Cancer
< 분류번호 : 232, 소화성궤양용제 > [ 허가사항변경지시 ( 안전성정보처리 ) ( 의약품안전평가과 - 호,... ) ] 라베프라졸나트륨단일제 ( 경구 ) ( R abeprazole Sodium) 사용상의주의사항 1. 다음환자에는투여하지말것. 1) 이약, 이약의구성
![< 분류번호 : 232, 소화성궤양용제 > [ 허가사항변경지시 ( 안전성정보처리 ) ( 의약품안전평가과 - 호,... ) ] 라베프라졸나트륨단일제 ( 경구 ) ( R abeprazole Sodium) 사용상의주의사항 1. 다음환자에는투여하지말것. 1) 이약, 이약의구성 < 분류번호 : 232, 소화성궤양용제 > [ 허가사항변경지시 ( 안전성정보처리 ) ( 의약품안전평가과 - 호,... ) ] 라베프라졸나트륨단일제 ( 경구 ) ( R abeprazole Sodium) 사용상의주의사항 1. 다음환자에는투여하지말것. 1) 이약, 이약의구성](/thumbs/98/138569817.jpg) < 분류번호 : 232, 소화성궤양용제 > [ 허가사항변경지시 ( 안전성정보처리 ) ( 의약품안전평가과 - 호,... ) ] 라베프라졸나트륨단일제 ( 경구 ) ( R abeprazole Sodium) 사용상의주의사항 1. 다음환자에는투여하지말것. 1) 이약, 이약의구성성분또는벤즈이미다졸류에과민반응및그병력이있는환자 2) 페니실린계 항생제에 과민반응 환자 ( 헬리코박터필로리
< 분류번호 : 232, 소화성궤양용제 > [ 허가사항변경지시 ( 안전성정보처리 ) ( 의약품안전평가과 - 호,... ) ] 라베프라졸나트륨단일제 ( 경구 ) ( R abeprazole Sodium) 사용상의주의사항 1. 다음환자에는투여하지말것. 1) 이약, 이약의구성성분또는벤즈이미다졸류에과민반응및그병력이있는환자 2) 페니실린계 항생제에 과민반응 환자 ( 헬리코박터필로리
가브스정 ( 빌다글립틴 ) - 50mg Galvus tab (vildagliptin) 원료약품의분량이약 1정 (200 mg) 중 유효성분 : 빌다글립틴 ( 별규 ) 50.0 밀리그램 첨가제 : 유당, 미결정셀룰로오스, 글리콜산전분나트륨, 스테아르산마그네슘 성상 흰색내지
 가브스정 ( 빌다글립틴 ) - 50mg Galvus tab (vildagliptin) 원료약품의분량이약 1정 (200 mg) 중 유효성분 : 빌다글립틴 ( 별규 ) 50.0 밀리그램 첨가제 : 유당, 미결정셀룰로오스, 글리콜산전분나트륨, 스테아르산마그네슘 성상 흰색내지밝은노란빛을띄는원형정제 효능 효과 이약은제 2 형당뇨병환자의혈당조절을향상시키기위해식사요법및운동요법의보조제로
가브스정 ( 빌다글립틴 ) - 50mg Galvus tab (vildagliptin) 원료약품의분량이약 1정 (200 mg) 중 유효성분 : 빌다글립틴 ( 별규 ) 50.0 밀리그램 첨가제 : 유당, 미결정셀룰로오스, 글리콜산전분나트륨, 스테아르산마그네슘 성상 흰색내지밝은노란빛을띄는원형정제 효능 효과 이약은제 2 형당뇨병환자의혈당조절을향상시키기위해식사요법및운동요법의보조제로
<5BB0EDB3ADB5B55D32303131B3E2B4EBBAF12DB0ED312D312DC1DFB0A32DC0B6C7D5B0FAC7D02D28312E28322920BAF2B9F0B0FA20BFF8C0DAC0C720C7FCBCBA2D3031292D3135B9AEC7D72E687770>
 고1 융합 과학 2011년도 1학기 중간고사 대비 다음 글을 읽고 물음에 답하시오. 1 빅뱅 우주론에서 수소와 헬륨 의 형성에 대한 설명으로 옳은 것을 보기에서 모두 고른 것은? 4 서술형 다음 그림은 수소와 헬륨의 동위 원 소의 을 모형으로 나타낸 것이. 우주에서 생성된 수소와 헬륨 의 질량비 는 약 3:1 이. (+)전하를 띠는 양성자와 전기적 중성인 중성자
고1 융합 과학 2011년도 1학기 중간고사 대비 다음 글을 읽고 물음에 답하시오. 1 빅뱅 우주론에서 수소와 헬륨 의 형성에 대한 설명으로 옳은 것을 보기에서 모두 고른 것은? 4 서술형 다음 그림은 수소와 헬륨의 동위 원 소의 을 모형으로 나타낸 것이. 우주에서 생성된 수소와 헬륨 의 질량비 는 약 3:1 이. (+)전하를 띠는 양성자와 전기적 중성인 중성자
전문의약품 PHARMACIA
 전문의약품 디트루시톨 SR 캡슐 2 mg, 4 mg ( 톨터로딘 -L- 타르타르산염 ) [ 원료약품의분량 ] 2 mg: 1캡슐 ( 약 91.79 mg) 중, 유효성분 : 톨터로딘-L-타르타르산염 ( 별규 ) 2 mg 첨가제 ( 타르색소 ): 청색 2호 기타첨가제 : 정제수, 청녹색캡슐, 히드록시프로필메칠셀룰로오스, Sugar Shperes, Surelease
전문의약품 디트루시톨 SR 캡슐 2 mg, 4 mg ( 톨터로딘 -L- 타르타르산염 ) [ 원료약품의분량 ] 2 mg: 1캡슐 ( 약 91.79 mg) 중, 유효성분 : 톨터로딘-L-타르타르산염 ( 별규 ) 2 mg 첨가제 ( 타르색소 ): 청색 2호 기타첨가제 : 정제수, 청녹색캡슐, 히드록시프로필메칠셀룰로오스, Sugar Shperes, Surelease
나프록센 (naproxen) 요약 나프록센은소염진통제이다. 단기요법으로는골격근장애, 급성통풍, 편두통, 수술후또는발치후통증완화등의목적으로사용되고, 장기요법으로는관절염, 강직성척추염등의만성질환의염증과통증을감소시키기위해사용된다. 급성질환에사용하는경우에는원인을치료하는것이아니
 요약 나프록센은소염진통제이다. 단기요법으로는골격근장애, 급성통풍, 편두통, 수술후또는발치후통증완화등의목적으로사용되고, 장기요법으로는관절염, 강직성척추염등의만성질환의염증과통증을감소시키기위해사용된다. 급성질환에사용하는경우에는원인을치료하는것이아니라증상을완화하는것이므로가능한한단기간만사용한다. 외국어표기 naproxen( 영어 ) CAS 등록번호 22204-53-1
요약 나프록센은소염진통제이다. 단기요법으로는골격근장애, 급성통풍, 편두통, 수술후또는발치후통증완화등의목적으로사용되고, 장기요법으로는관절염, 강직성척추염등의만성질환의염증과통증을감소시키기위해사용된다. 급성질환에사용하는경우에는원인을치료하는것이아니라증상을완화하는것이므로가능한한단기간만사용한다. 외국어표기 naproxen( 영어 ) CAS 등록번호 22204-53-1
[NO_11] 의과대학 소식지_OK(P)
![[NO_11] 의과대학 소식지_OK(P) [NO_11] 의과대학 소식지_OK(P)](/thumbs/40/20572420.jpg) 진 의학 지식과 매칭이 되어, 인류의 의학지식의 수준을 높 여가는 것이다. 하지만 딥러닝은 블랙박스와 같은 속성을 가지고 있어서, 우리는 단지 결과만을 알 수 있기 때문에 이런 식의 의학지 식의 확장으로 이어지기는 힘들 수 있다는 것을 의미한다. 이것은 실제로 의학에서는 인공지능을 사용하게 될 때 여러 가지 문제를 만들 수 있다. 뿐만 아니라, 인간이 이해
진 의학 지식과 매칭이 되어, 인류의 의학지식의 수준을 높 여가는 것이다. 하지만 딥러닝은 블랙박스와 같은 속성을 가지고 있어서, 우리는 단지 결과만을 알 수 있기 때문에 이런 식의 의학지 식의 확장으로 이어지기는 힘들 수 있다는 것을 의미한다. 이것은 실제로 의학에서는 인공지능을 사용하게 될 때 여러 가지 문제를 만들 수 있다. 뿐만 아니라, 인간이 이해
³»Áö_10-6
 역사 속에서 찾은 청렴 이야기 이 책에서는 단순히 가난한 관리들의 이야기보다는 국가와 백성을 위하여 사심 없이 헌신한 옛 공직자들의 사례들을 발굴하여 수록하였습니다. 공과 사를 엄정히 구분하고, 외부의 압력에 흔들리지 않고 소신껏 공무를 처리한 사례, 역사 속에서 찾은 청렴 이야기 관아의 오동나무는 나라의 것이다 관아의 오동나무는 나라의 것이다 최부, 송흠
역사 속에서 찾은 청렴 이야기 이 책에서는 단순히 가난한 관리들의 이야기보다는 국가와 백성을 위하여 사심 없이 헌신한 옛 공직자들의 사례들을 발굴하여 수록하였습니다. 공과 사를 엄정히 구분하고, 외부의 압력에 흔들리지 않고 소신껏 공무를 처리한 사례, 역사 속에서 찾은 청렴 이야기 관아의 오동나무는 나라의 것이다 관아의 오동나무는 나라의 것이다 최부, 송흠
제품설명서Template
 전문의약품 타조신주 2.25 그람, 4.5 그람 Tazocin 2.25g, 4.5 g for Injection 원료약품의분량 - 2.25 g - 1바이알중피페라실린 (USP).. 2000mg 타조박탐 (USP) 250mg 첨가제 : 구연산일수화물, 에데트산나트륨이수화물 - 4.5 g - 1바이알중피페라실린 (USP).. 4000mg 타조박탐 (USP) 500mg
전문의약품 타조신주 2.25 그람, 4.5 그람 Tazocin 2.25g, 4.5 g for Injection 원료약품의분량 - 2.25 g - 1바이알중피페라실린 (USP).. 2000mg 타조박탐 (USP) 250mg 첨가제 : 구연산일수화물, 에데트산나트륨이수화물 - 4.5 g - 1바이알중피페라실린 (USP).. 4000mg 타조박탐 (USP) 500mg
산디문뉴오랄연질캡슐 ( 사이클로스포린 ) - 25mg, 100mg Sandimmun Neoral soft gelatin capsule (cyclosporine) 원료약품의분량 1 캡슐중 주성분 : 사이클로스포린 (USP) mg, 100 mg 성상 25mg:
 산디문뉴오랄연질캡슐 ( 사이클로스포린 ) - 25mg, 100mg Sandimmun Neoral soft gelatin capsule (cyclosporine) 원료약품의분량 1 캡슐중 주성분 : 사이클로스포린 (USP)... 25 mg, 100 mg 성상 25mg: 기름또는알코올냄새가있는엷은황색 ~ 엷은황갈색의마이크로에멀젼액을함유하는청회색난원형의연질캡슐 100mg:
산디문뉴오랄연질캡슐 ( 사이클로스포린 ) - 25mg, 100mg Sandimmun Neoral soft gelatin capsule (cyclosporine) 원료약품의분량 1 캡슐중 주성분 : 사이클로스포린 (USP)... 25 mg, 100 mg 성상 25mg: 기름또는알코올냄새가있는엷은황색 ~ 엷은황갈색의마이크로에멀젼액을함유하는청회색난원형의연질캡슐 100mg:
전문의약품
 전문의약품 뉴론틴 정 600 mg, 800 mg ( 가바펜틴 ) Neurontin Tablets 600 mg, 800 mg (gabapentin) [ 원료약품의분량 ] 600 mg : 매정당가바펜틴 ( 별규 ) 600 mg 800 mg : 매정당가바펜틴 ( 별규 ) 800 mg [ 성상 ] 600 mg : 흰색의타원형필름코팅정제 800 mg : 흰색의타원형필름코팅정제
전문의약품 뉴론틴 정 600 mg, 800 mg ( 가바펜틴 ) Neurontin Tablets 600 mg, 800 mg (gabapentin) [ 원료약품의분량 ] 600 mg : 매정당가바펜틴 ( 별규 ) 600 mg 800 mg : 매정당가바펜틴 ( 별규 ) 800 mg [ 성상 ] 600 mg : 흰색의타원형필름코팅정제 800 mg : 흰색의타원형필름코팅정제
조스타박스주(대상포진생바이러스백신)
 가다실 R 주 / 프리필드시린지 [ 인유두종바이러스 4 가 (6, 11, 16, 18 형 ) 백신 ( 유전자재조합 )] 원료약품및그분량 1 바이알 / 프리필드시린지 (0.5 ml) 중 주성분 : 인유두종바이러스 6형 L1 단백질 ( 별규 ) 20 μg ( 유전자재조합, 숙주 : Saccharomyces cerevisiae, 벡터 : pgal110 효모발현벡터
가다실 R 주 / 프리필드시린지 [ 인유두종바이러스 4 가 (6, 11, 16, 18 형 ) 백신 ( 유전자재조합 )] 원료약품및그분량 1 바이알 / 프리필드시린지 (0.5 ml) 중 주성분 : 인유두종바이러스 6형 L1 단백질 ( 별규 ) 20 μg ( 유전자재조합, 숙주 : Saccharomyces cerevisiae, 벡터 : pgal110 효모발현벡터
½Ç°ú¸Ó¸®¸»¸ñÂ÷ÆDZÇ(1-5)¿Ï
 실과056-094 2013.1.9 7:22 PM 페이지67 MDPREP_RipControl 2007 개정 5학년 검정 지도서 각론 알짜 정리 67 영양소 힘을 내는 일(탄수화물/지방/단백질) 몸의 조직 구성(지방/단백질/무기질/물) 몸의 기능 조절(단백질/무기질/비타민/물) 식품 구성 자전거의 식품과 영양소 식품군 곡류 탄수화물 우리가 활동하는데 필요한 힘을
실과056-094 2013.1.9 7:22 PM 페이지67 MDPREP_RipControl 2007 개정 5학년 검정 지도서 각론 알짜 정리 67 영양소 힘을 내는 일(탄수화물/지방/단백질) 몸의 조직 구성(지방/단백질/무기질/물) 몸의 기능 조절(단백질/무기질/비타민/물) 식품 구성 자전거의 식품과 영양소 식품군 곡류 탄수화물 우리가 활동하는데 필요한 힘을
전문의약품 의약품분류번호 616 암비솜주사 ( 주사용리포좀화한암포테리신 B) 원료약품및분량 1 바이알중주성분 : 암포테리신 B 50 mg ( 역가 ) 첨가제 ( 안정제 ) : 알파토코페롤 0.64 mg, 백당 900 mg 그외첨가제 : 수소화대두포스파티딜콜린, 디스테아
 전문의약품 의약품분류번호 616 암비솜주사 ( 주사용리포좀화한암포테리신 B) 원료약품및분량 1 바이알중주성분 : 암포테리신 B 50 mg ( 역가 ) 첨가제 ( 안정제 ) : 알파토코페롤 0.64 mg, 백당 900 mg 그외첨가제 : 수소화대두포스파티딜콜린, 디스테아로일포스파티딜글리세롤, 콜레스테롤, 호박산이나트륨육수화물, 염산, 수산화나트륨 성상 노란색의리포좀화한동결건조덩어리또는가루가충진된바이알
전문의약품 의약품분류번호 616 암비솜주사 ( 주사용리포좀화한암포테리신 B) 원료약품및분량 1 바이알중주성분 : 암포테리신 B 50 mg ( 역가 ) 첨가제 ( 안정제 ) : 알파토코페롤 0.64 mg, 백당 900 mg 그외첨가제 : 수소화대두포스파티딜콜린, 디스테아로일포스파티딜글리세롤, 콜레스테롤, 호박산이나트륨육수화물, 염산, 수산화나트륨 성상 노란색의리포좀화한동결건조덩어리또는가루가충진된바이알
 32P SPECIALDAY ECO HEALING 32 LET S GO 36P 38P 36 HEALING & FEELING 38 TALK TO THEME FOREST IS STUDIO 46P 42 PLAY TO THEME FOREST IS STUDIO FOREST... ECO HEALING SPACE 50 FOREST+INTERIOR 46 FOREST+FASHION
32P SPECIALDAY ECO HEALING 32 LET S GO 36P 38P 36 HEALING & FEELING 38 TALK TO THEME FOREST IS STUDIO 46P 42 PLAY TO THEME FOREST IS STUDIO FOREST... ECO HEALING SPACE 50 FOREST+INTERIOR 46 FOREST+FASHION
Pfizer Pharmaceuticals Korea LTD
 전문의약품 지스로맥스 정 250 mg ( 아지트로마이신수화물 ) [ 원료약품의분량 ] 1 정 (468.00 mg) 중, 유효성분 : 아지트로마이신수화물 (KP).. 250.00 mg ( 역가 ) 첨가제 : 라우릴황산나트륨, 무수인산수소칼슘, 스테아르산마그네슘, 오파드라이화이트 ǁ(Y- 30-18037), 젤라틴화전분, 크로스카르멜로스나트륨 [ 성상 ] 백색의캡슐모양필름코팅정
전문의약품 지스로맥스 정 250 mg ( 아지트로마이신수화물 ) [ 원료약품의분량 ] 1 정 (468.00 mg) 중, 유효성분 : 아지트로마이신수화물 (KP).. 250.00 mg ( 역가 ) 첨가제 : 라우릴황산나트륨, 무수인산수소칼슘, 스테아르산마그네슘, 오파드라이화이트 ǁ(Y- 30-18037), 젤라틴화전분, 크로스카르멜로스나트륨 [ 성상 ] 백색의캡슐모양필름코팅정